早期阿尔茨海默病的发病与大脑中枢区域tau病理
2022-11-03 brainnew神内神外 brainnew神内神外
散发性阿尔茨海默病(AD)具有高度异质性,不同的临床表现、症状发作的年龄以及认知和神经病理轨迹。
导读:
阿尔茨海默病 (AD) 的症状较早发作和疾病进展与tau蛋白的扩散密切相关,但是潜在机制尚不清楚。近日,在《Nature Communications》上发表了一篇题为”Earlier Alzheimer’s disease onset is associated with tau pathology in brain hub regions and facilitated tau spreading”的论文,作者在对照组和生物标志物确认的AD患者中通过静息状态fMRI 结合纵向 tau-PET 发现:年轻的有症状AD患者的整体的额顶叶中枢(对维持AD认知至关重要的区域)显示出更显著的tau-PET。该区域的 tau-PET 与随后的 tau快速累积相关,表明整体连接区域中的 tau 促进了连接介导的 tau 传播。此外,中心区更@强的 tau-PET 介导了年轻的有症状的 AD 患者与更快的 tau 积累之间的关联,提示更快的认知能力下降。这些研究结果表明,较年轻的 AD 症状发作与大脑中枢中更强的 tau 病理相关,并加速 tau 在连接的大脑区域的扩散和认知能力下降。

散发性阿尔茨海默病(AD)具有高度异质性,不同的临床表现、症状发作的年龄以及认知和神经病理轨迹。在散发性AD中,症状出现较早与tau积累加速、神经退行性变、更快的认知衰退和更高的死亡率相关,这些共同表明更年轻的症状发作可能是由更严重的AD形式驱动。然而,为什么症状发作较早的散发AD患者比症状发作较晚的患者表现出更快的病理和临床进展?从组织病理学的角度来看,早发性和迟发性散发性AD具有相同的分子病理学,包括淀粉样蛋白-β(Aβ)斑块和由过度磷酸化的tau病理形成的神经原纤维缠结,这表明较早的症状发作不太可能由AD病理的独特分子特征具体驱动。相反,先前的尸检和tau-PET成像研究报告显示,早期AD症状发作与tau病理的不同空间分布模式相关,即AD神经退行性变和认知能力下降的关键驱动因素。具体而言,对AD患者的尸检评估发现,更明显的新皮层和海马保留模式的神经纤维tau病理与症状发作时的年龄较小和死前认知下降较快相关,而空间上受限制的边缘为主的神经原纤维模式的tau病理与症状发作时年龄较大和死前认知下降较慢有关。同样,对AD患者进行tau-PET研究发现,年纪较轻的AD患者和早发性AD(65岁之前)的额顶叶联合皮层区域的tau-PET摄取更强,内侧颞叶区域相对较少。总之,这些研究结果表明,AD的早期症状发作与tau病理沉积从不均皮质内侧颞叶区域向新皮质额顶叶联合皮质的模式转变有关。如功能性MRI研究所示,额顶叶区域拥有与大脑其他部分整体连接的关键枢纽,是认知功能的中心,它们在认知需求期间促进跨不同大脑网络的信息整合。
之前的一系列功能MRI研究已经证明额顶叶控制网络中枢的功能完整性对衰老、AD和其他神经退行性疾病患者维持认知功能的重要性。由于tau病理已被证明会损害神经元功能并驱动神经退行性变,因此与认知高度相关的额顶叶中枢区域更强的tau病理负荷可能会驱动AD的早期症状表现。此外,整体连接的枢纽区域的tau病理沉积可能会进一步加速tau病理本身的进展和扩散,反过来又是认知下降的强大驱动力。具体而言,临床前研究一致表明,tau在相互连接的神经元中跨突触传播。同样,之前在联合tau-PET和MRI的研究中表明,tau优先在功能和解剖连接的大脑区域中传播,其中tau包含中心区域的连接模式决定了随后tau病理的传播模式。因此,AD早期在整体连接的枢纽中发生tau病理可能会导致更快和更广泛的tau扩散,从而推动更早的疾病表现和更快的临床进展。
为了解决这些问题,作者联合tau-PET和静息状态fMRI研究的主要目的是评估:(1)在有症状的AD患者中,与非中枢区域相比,在整体连接的中枢区域中,较年轻的症状出现年龄是否与更强的tau病理相关;(2)中枢区域的tau病理是否与随后的tau加速扩散有关;(3)在有症状的AD中,更年轻和更快的tau积累率之间的关联是否由整体连接的枢纽区域更强的tau病理介导。为此,作者采用了涵盖整个AD谱的两个独立样本,包括AD神经影像学倡议(ADNI)的240名参与者和BioFINDER研究的57名受试者进行重复,均具有可用的基线淀粉样蛋白-PET和纵向Flortaucipirtau-PET。为了绘制跨大脑的整体连接枢纽的拓扑结构,作者使用了来自人类连接组计划(HCP)的1000名健康参与者的高分辨率静息状态fMRI数据。基于这些静息态fMRI数据,作者估算了未受AD病理影响的健康个体的基于图谱理论度量加权程度(也被称为整体连接)的全脑图谱。通过将AD患者的个体tau-PET模式映射到整体连接的大脑中枢的拓扑结构,作者确定了单个tau-PET模式在额顶联合皮层的整体连接中枢区域与弱连接的非中枢区域(例如颞边缘和视觉皮层区域)中表达的程度。基于这些数据,作者发现:(1)在整体连接的中心区域,有症状AD的年轻患者tau-PET沉积更明显,并且与早期症状发作相关;(2)基线时tau病理沉积更类似于枢纽的模式与随后的每年tau积累加速有关;(3)症状性AD中较年轻和较快的tau积累率之间的关联可能是由类似于中枢的tau-PET模式介导,从而导致更快的认知衰退。
结果
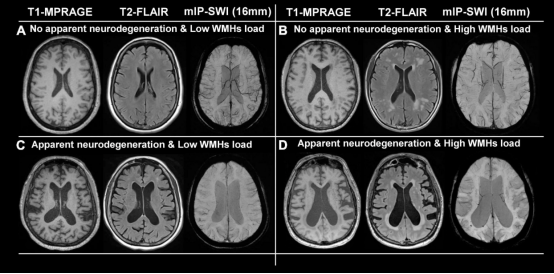
本次研究中作者纳入了两个完全独立的样本(ADNI和BioFINDER),具有基线淀粉样蛋白-PET和纵向Flortaucipirtau-PET基线数据。作者进一步纳入了记忆合成的纵向认知数据以及症状性AD患者的症状发作年龄估计值,这些数据可用于ADNI中的一个子集。两个样本都包括没有AD病理学证据的认知正常(CN)对照受试者(ADNI/BioFINDER, n=93/16)、CN淀粉样蛋白阳性个体(即临床前AD, ADNI/BioFINDER, n=60/16)和有症状的AD患者(包括即轻度认知障碍(MCI)和ADADNI/Bio-FINDER,n=89/25)。两个样本的受试者人口统计数据显示在表1中。
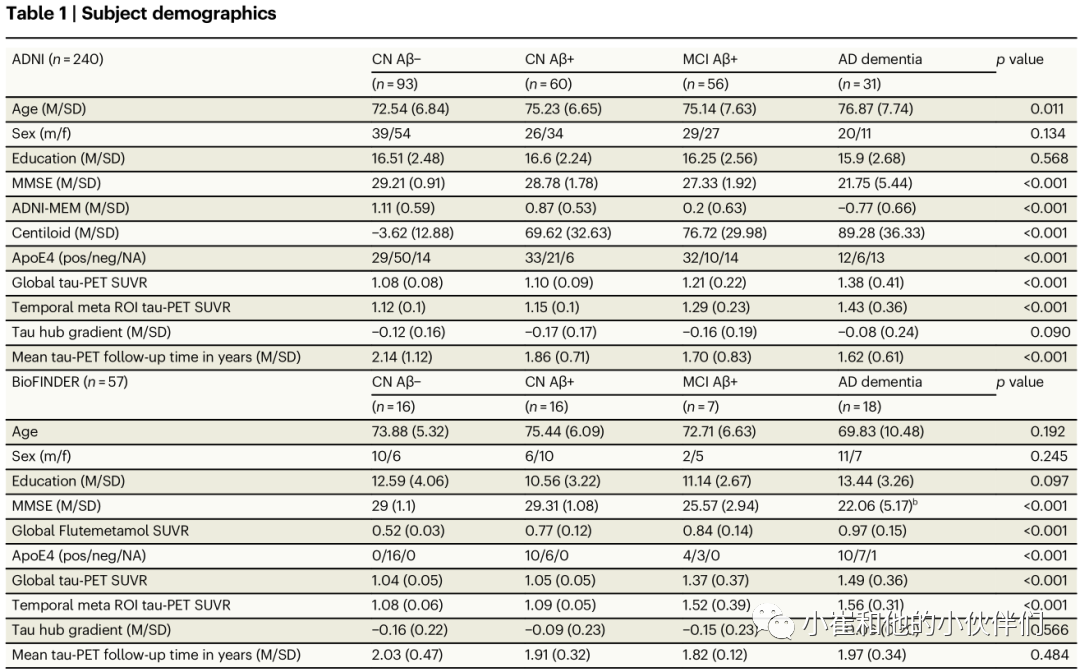
表1. 两个样本的受试者人口统计数据
来自1000名HCP参与者的静息状态fMRI数据用于估计覆盖新皮质的Schaefer200感兴趣区域(ROI)图集的健康连接模板(图1 A)。在1000名HCP参与者中,作者创建了一个组平均功能连接矩阵,其密度阈值为30%,以消除潜在的弱连接和噪声连接,并转换为基于连接的距离(即更高的功能连接=更短的连接距离,图1 B)。然后,对于每个ROI,作者确定该ROI到其余ROI的基于连接的平均距离作为中心度的度量(即到大脑其他部分的距离较短=中心度越高,图1 C),这相当于图表理论测量加权度。与之前的研究一致,枢纽区域主要位于额顶联合皮层中。为了确定在中枢和非中枢之间缩放大脑区域的中枢图,组平均全局连接图(图1 C)在1(即中枢)和-1(即非中枢)之间重新缩放(图1 D),以便在后面的步骤中评估单个tau-PET模式是否与中心或非中心模式匹配。使用相同的200ROI分割(图1 A)对Tau-PETSUVR数据(即归一化到小脑下灰色的强度)进行分割,并应用预先建立的二分量高斯混合模型(图1 E)来变换tau-PETSUVR(标准化吸收值比)到tau-PET阳性,以便将脱靶与在靶tau-PET结合区分开来。在另一个探索步骤中,作者还包括了来自预先建立的海马ROI的tau-PETSUVR,它排除了脉络丛,因此最大限度的减少了对Flortaucipir脱靶结合的影响。至于剩下的皮层,海马tau-PETSUVR进行了二分量高斯混合建模,以进一步减少脱靶结合的影响。ADNI和BioFINDER的诊断组基线tau-PET阳性的表面呈现如图1 F所示,在淀粉样蛋白阴性的对照组中,没有tau-PET阳性的证据,临床前AD中颞叶tau水平轻微升高,而在患有MCI和AD痴呆的症状性AD患者中,tau-PET阳性逐渐增加。

图1. fMRI 和tau-PET处理
在有症状的AD中,年龄越小似乎与中枢的tau-PET模式越相关
为了评估个体tau-PET沉积代表枢纽或非枢纽模式的程度,作者将患者特异性tau-PET阳性映射到图1D所示的放缩枢纽图上。具体来说,作者将特定ROI明确个体的tau阳性与缩放比例相乘(图1 D)所示的枢纽图,以确定中心加权tau阳性值,随后将其平均并除以所有200个ROI的整体tau-PET阳性值,以调整整体tau沉积。作者对整体tau水平进行调整,使tau中心比率反映tau的沉积模式,而不是整体tau严重程度。特定个体的tau-PET模式到缩放枢纽图的映射如图1 G-M所示,产生一个数字索引(tau中心比率),指示特定个体的tau-PET模式是否更能代表中心区域(即更阳性)或非中心地区(即更阴性),同时调整整体tau-PET阳性。使用ANOVA方法判断组间tau中心比率没有差异(表1,ADNI,p=0.090,BioFINDER,p=0.566),表明tau中心比率确实引起了tau沉积的空间模式,但没有增加诊断错误。然后,作者使用控制了性别、教育程度和诊断的线性回归,判断症状出现年龄较小是否与症状性AD(即MCI和痴呆)患者的tau中心比率较高相关。作者发现两个样本有症状的AD患者的年龄较小与阳性更强的tau中心比率相关(ADNI:β=-0.238,p=0.024,图2 A;BioFINDER:β=-0.482,p=0.018,图2 B)。使用改组连接组作为参考生成的空模型tau中心比率的1000个beta值的精确测试证实了这些结果(ADNI:p=0.016;BioFINDER:p=0.019)。此外,在具有可用静息状态fMRI数据的38名有症状ADNI参与者中,当使用受试者级连接数据和tau-PET确定tau中心比率时,这种关联是一致的(b=-0.307,p=0.037)。当控制整体Aβ水平或ApoE亚型时,结果也仍然显著。相反,对于临床前AD的无症状患者,未检测到年龄与tau中心比率之间的关联(ADNI:β=0.087,p=0.542,图2 A;BioFINDER:β=-0.307,p=0.901,图2B),其中异常tau-PET信号最小。当基于信息者评估(即在77/89有症状的ADNI参与者)对与认知症状发作的实际年龄重复上述分析时(即在77/89有症状的ADNI参与者),作者发现了一致的结果,表明症状发作的年龄越小则tau的中心占比越高(β=-0.256,p=0.024,图3 A)。此外,作者还测试了tau病理的中心(即10%的具有最高基线tau-PET阳性的脑区)是否更有可能位于年轻有症状AD患者的整体连接区域对于中心的映射(中心的解剖位置在源数据文件中标记)。作者发现在有症状的AD患者中,较小的年龄确实与tau中心有较强的中枢性(即与大脑其他部分的连接距离更短)相关(ADNI:β=0.300,p=0<0.001,图2 C;BioFINDER:β=0.646,p<0.001,图2 D)进一步支持该观点。在控制性别及教育程度前提下,在临床前AD中没有观察到这种结果模式(图2 D)。在ADNI,作者用基于知情人的认知症状发作年龄重复了这些分析,发现了一致的结果,表明较年轻的发病年龄与tau更强的中心性相关(即与大脑其他部分的基于连接的距离较短)(β=0.352,p=0.002,图3 B)。总之,这些结果支持了这样一个假设,即较年轻的AD症状发作与功能中心区域中更强的tau病理相关,这些区域与大脑的其他部分连接紧密。
作者进一步探索了淀粉样蛋白阳性ApoE4非携带者是否表现出更强的tau中心比率,因为之前研究表明,在AD患者中,ApoE4携带者与边缘为主的tau病理模式相关,而淀粉样蛋白阳性ApoE4非携带者则表现出更多的新皮质tau病理模式。将海马tau-PET纳入分析时,所有上述结果均保持一致。

图2. 年龄越小与症状性AD的中枢比率越高有关
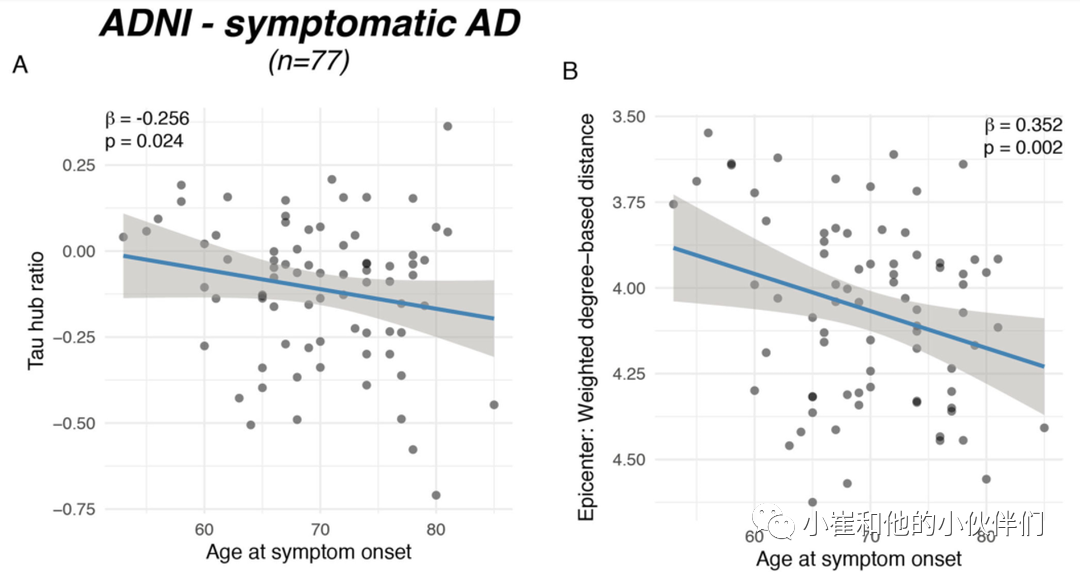
图3. 较早的症状发作与较高的tau中心比率相关
较年轻的症状出现时间和较高的tau中心比率与症状性AD中更快的tau积累有关
进一步,作者测试了在有症状的AD患者中,年龄越小是否与更快的tau积累率(即整体tau阳性的年变化率)相关。与之前的工作一致,采用线性回归控制性别、教育程度和诊断后作者发现,在有症状的AD患者中,年龄越小与整体tau-PET阳性率的年变化率越快相关(ADNI:β=-0.284,p=0.009,图4 B;BioFINDER:β=-0.836,p<0.001,图4 C)。正如预期的那样,在临床前AD患者中未检测到较小年龄和更快的tau积累之间的关联(ADNI:β=-0.119,p=0.389,图4 B;BioFINDER:β=0.208,p=0.448,图4 C),表明较快的tau积累或一般在年龄较小的tau积累对有症状的AD受试者是特异性的。接下来,作者测试了较高的tau中心比率(表明更类似枢纽的tau-PET沉积模式)是否与更快的整体tau积累有关。这项分析由作者之前的发现激发的,表明tau从特定的中枢区域扩散到连接的大脑区域。因此,整体连接的枢纽区域的tau病理应该导致更广泛的tau传播和更快的tau积累。相反,tau在弱连接的非枢纽区域应导致较慢的传播和tau积累(图4 A)。支持这个观点,作者发现在控制性别、教育程度和诊断前提下,基线时较高的tau中心比率则有症状AD患者随后的tau积累更快(ADNI:β=0.347,p=0.006,图4 D;BioFINDER:β=0.668,p=0.002,图4 E)。使用来自空模型tau中心比率的1000个beta值进行精确测试,用改组的连接组作为参考,证实了这些结果(ADNI:p=0.010;BioFINDER:p=0.018)。当额外控制年龄时,该结果保持一致(ADNI:β=0.259,p=0.009;BioFINDER:β=0.311,p=0.026),表明tau中心比率对更快的tau积累有独特的贡献。在临床前AD患者中,作者还发现在控制性别及教育程度前提下,基线时较高的tau中心比率与ADNI中较快的后续tau积累率之间存在显着关联(β=0.347,p=0.006,图4 D),但是这一发现无法在BioFINDER中复现(β=0.199,p=0.469,图4 E)。总之,这些结果表明,在有症状的AD患者中,较小的出现症状的年龄和更类似中枢的tau-PET模式与tau病理的更快积累有关。同样,将海马tau-PET纳入分析时,这些结果保持一致。
为了进一步证实确实是tau病理在中心的空间分布,而不是tau病理的整体严重程度导致tau快速积累和早期疾病表现,作者进行了进一步分析。作者对ADNI和BioFINDER的Aβ+受试者进行了从低到高的整体tau滑动窗口分析,并评估了每个窗口的平均年度tau-PET变化和年龄,按高与低tau分层集中心比率(即中值分割)或基于高与低中心连接的距离分层。作者发现整体tau-PET和tau中心比率对tau年累积率有显著相互作用,在较高的tau-PET基线水平前提下,tau中心比率越高,tau积累越快。同样,作者发现在有症状的AD患者中,总体tau-PET和tau中心比值之间存在相互作用,在较高的tau-PET水平条件下,tau中心比值越高,则出现症状的年龄越小。这些分析支持这样一种观点,即较高的tau中心比率比与AD中给定tau蛋白病理水平下更快的tau蛋白积累有关,也与症状性AD中较年轻的tau蛋白积累有关。同样,更多整体连接中心与后续更快的tau积累相关。
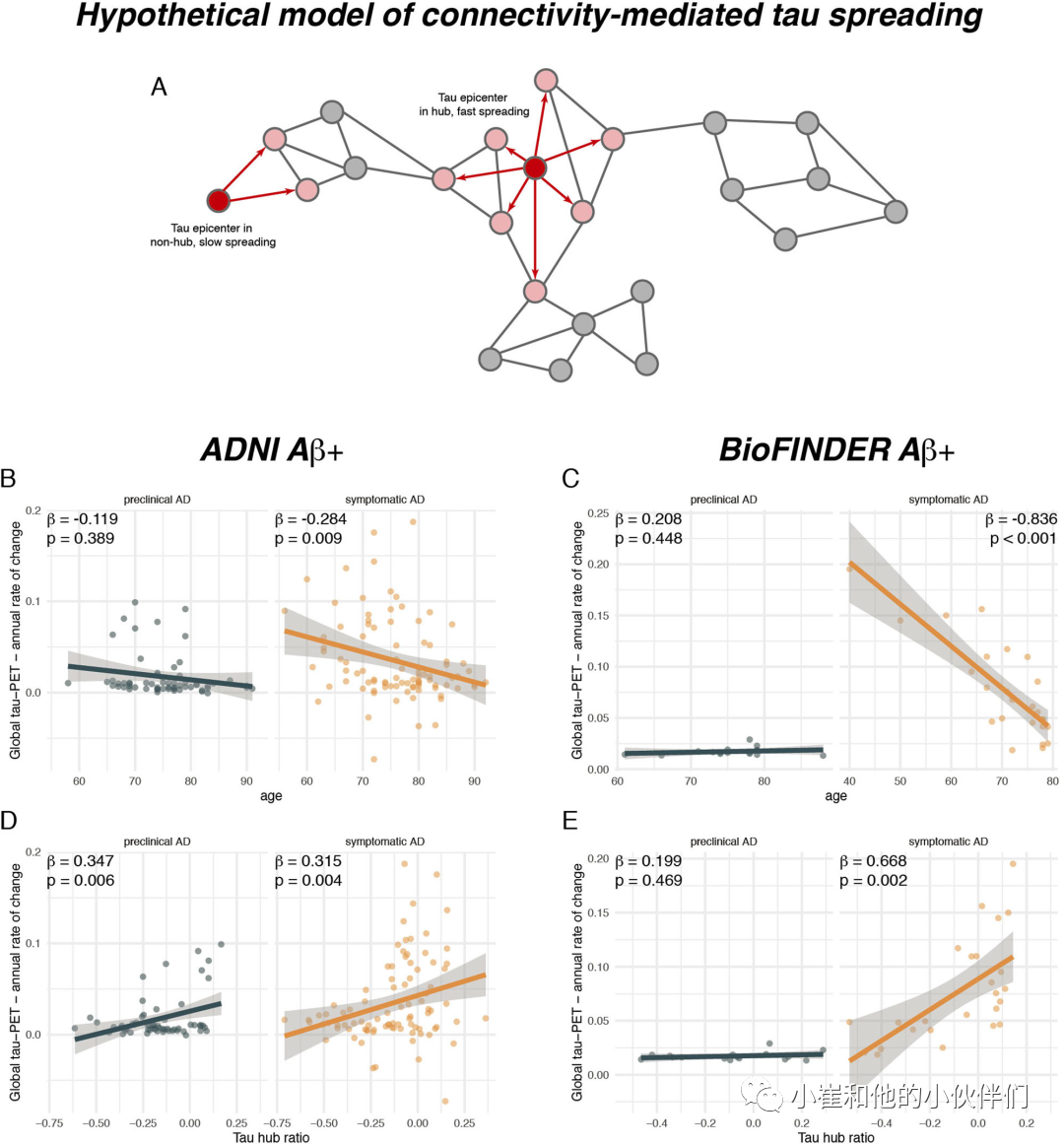
图4. 较高的tau中心比率有助于tau扩散
较高的tau中心比率介导了症状性AD中较小的年龄和较快的tau积累之间的关联
最后,作者在有症状的AD患者中评估症状出现的年龄越小对tau积累速度越快的影响是否是通过更高的tau中心比率介导。通过10,000次迭代的自展调解分析,作者发现在控制性别、教育程度和诊断前提下,ADNI(β=-0.065,95%CI[-0.153;0.00], p=0.039)和BioFINDER(β=-0.149,95%CI[-0.371;0.00],p=0.046)均存在显著的中介效应。如图5 A所示:较高的tau中心比率介导了症状性AD患者较年轻和较快tau积累率之间的关联。当纳入海马tau-PET时,这些数据保持一致。使用ADNI样本的症状性AD患者中可用的纵向认知数据,进一步表明,每年tau蛋白更多的积累与更快的记忆下降相关(即ADNI-mem,β=0.322,p=0.004,图5 B,控制年龄、性别和教育程度),这表明由较高的tau中心比率介导的tau快速积累可能导致临床AD的年轻患者更快的临床恶化。同样,当包括海马tau-PET时,这种关联保持一致(β-0.315,p=0.004)。使用上面介绍的滑动窗口方法确认这些分析,作者发现基线整体tau-PET和tau中心比率之间的交互作用影响ADNI-MEM年度变化,在较高的整体tau水平下,较高的tau中心比率与更快的认知衰退相关。

图5. 年龄较小和更快的tau积累之间的关联由更高的tau中心比率介导
讨论
主要发现:首先,有症状的AD的年轻患者表现出更类似中枢的PET评估tau沉积模式,在高度连接的大脑区域有较强的tau病理,这对整体认知至关重要,作者之前已经证明,它是AD患者维持认知表现的核心。重要的是,在淀粉样蛋白阳性但无症状的个体(即临床前AD)中没有检测到这些关联。这支持以前的观点:tau病理是AD症状的关键驱动因素;同时增加了重要的新证据,整体连接的中心区更强的tau沉积与早期的AD症状表现有关。其次,作者发现在整体连接中心区,出现症状的年龄越小和tau病理负荷越强,预示有症状的AD患者随后的tau积累会更快,这与记忆力下降更快有关。假设连接性是tau传播的关键媒介,因此这些结果支持在疾病过程的早期,整体连接中心的病理可能导致tau病理在连接的大脑区域中更广泛的传播,从而导致早期症状性AD患者的认知能力更快恶化。在有症状的AD患者中,年轻化和更快的tau积累之间的关联是由中枢区域更强的ta病理介导的。总之,这篇文章表明tau病理沉积倾向对认知至关重要的整体连接的大脑中枢,可能决定早期症状性疾病的表现并加速连接介导的tau传播。AD症状表现较年轻的患者在额顶联合皮层的整体连接枢纽中表现出更强的tau病理。这一发现与之前的验尸和体内tau-PET证据非常吻合,表明较年轻的症状性AD发病与更多的新皮质边缘保留tau病理模式相关,而症状发作的年龄较大与边缘为主的tau病理模式相关。同样,先前的研究表明,较年轻的症状性AD发病与更强的额顶叶灰质萎缩、低灌注和葡萄糖代谢水平降低有关,这些已被证明与tau病理密切相关。总之,这表明是空间模式而不仅仅是tau病理的程度决定了AD症状表现的可能性、类型和侵袭性。作者先前发现,更高的全局连接额顶叶控制网络枢纽,如左额叶皮层,与更有效的整体大脑网络拓扑和后扣带回葡萄糖代谢减退、海马萎缩或内嗅tau病理对认知表现的降低影响相关。这表明保持中心区域的完整性可能会促进对AD病理对认知影响的恢复能力。反过来,对中枢区域的损害已被证明会降低大脑网络之间的有效沟通,而对脑血管疾病患者的临床研究表明,中枢区域的局灶性病变会导致全脑网络破坏,并且比非中枢区域的病变更严重。在临床前和临床研究中,Tau病理已被证明会破坏神经元活动和连接,因此在枢纽区域早期发生tau病理可能导致整体脑网络功能的早期损害,从而更早地出现认知障碍。在这里,下一步需要关注的是枢纽中较高的tau病理是否会导致枢纽连接中断,从而导致早期症状出现。对于作者的第二个发现,作者证明在有症状的AD中,症状出现的时间越早与更强的tau中心比率与更快的tau积累有关,这是对之前临床前和临床工作的重要扩展,表明大脑连接介导tau扩散。对小鼠和神经元细胞培养物的研究发现,tau跨突触传播,其中较高的突触活动促进tau传播。同样,作者在AD患者的MRI和tau-PET联合研究中报道,基于tau的种子式连接预测tau扩散模式,其中tau优先从中心扩散到连接区域。因此,与具有较少连接的非中心区域相比,具有广泛连接的tau中心区域可以增强tau向连接区域的扩散。支持这一观点的是,作者发现年轻有症状的AD患者在整体连接的大脑区域中具有最高tau病理区域(即中心),并且更强的tau中心比率与更快的tau积累有关。重要的是,作者的研究结果还为先前关于年轻AD患者中tau积累率更快的结果提供了解释机制。重要的是,tau的快速积累与记忆力的快速下降有关,这支持了tau的快速积累推动具有早期症状表现的AD患者临床快速进展的观点。
总之,作者研究结果表明有症状的年轻AD患者在整体连接的枢纽中表现出更强的tau病理,这可能会推动更快的tau传播和加速认知衰退。这表明早期症状表现不是由特定的病理生理特征驱动的,而是由一种tau分布模式优先针对认知功能重要的大脑中枢。这些结果与之前的研究结果吻合良好,表明不同的tau分布模式与不同的临床轨迹、不同的症状发作和疾病进展相关。因此,确定空间可变tau病理发病的潜在决定因素将是未来的一个关键目标,例如差异基因表达模式、预先存在的tau病理,脑网络架构中的病前差异和/或异质性。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言