柳叶刀子刊:帕博利珠单抗联合仑伐替尼作为晚期非透明细胞肾细胞癌的一线疗法 (KEYNOTE-B61):单臂、多中心、2 期试验
2023-07-14 daikun MedSci原创 发表于上海
该研究旨在评估帕博利珠单抗联合仑伐替尼作为晚期非透明细胞肾细胞癌的一线治疗的疗效和安全性
背景:基于免疫治疗的组合(包括帕博利珠单抗加仑伐替尼)是一线透明细胞肾细胞癌患者的标准治疗方法,但这些组合在非透明细胞肾细胞癌中的特征尚不明确。近期发表在The Lancet Oncology的一项2期临床研究评估了帕博利珠单抗联合仑伐替尼作为晚期非透明细胞肾细胞癌患者一线治疗的活性和安全性。

方法:KEYNOTE-B61 是一项单臂 2 期试验,正在 14 个国家(澳大利亚、加拿大、法国、匈牙利、爱尔兰、意大利、波兰、韩国、俄罗斯、西班牙、土耳其、乌克兰、英国和美国)进行。纳入患者为既往未经治疗的IV期非透明细胞肾细胞癌的成年患者(年龄≥18岁),且Karnofsky活动状态为70%或更。所有入选患者每6周静脉注射一次400 mg 帕博利珠单抗,持续18个周期(2年),加上口服20 mg仑伐替尼,每天一次或直到疾病进展、不可接受的毒性或停药;仑伐替尼可以持续使用2年以上。
主要终点是独立中央审查根据调整后的实体瘤疗效评价标准(1.1版)评估的具有确认客观反应的患者比例。对所有至少接受一剂研究治疗的患者(治疗人群)的进行了活性和安全性分析。
结果:在2021年2月23日-2022年1月21日期间,对215名患者进行了筛查;158人入选并接受治疗。基线时的中位年龄为60岁(IQR 52-69),158名患者中有112名(71%)为男性,46名(29%)为女性,128名(81%)为白人,12名(8%)为亚裔,3名(2%)为黑人或非裔美国人,15名(9%)缺失种族数据。


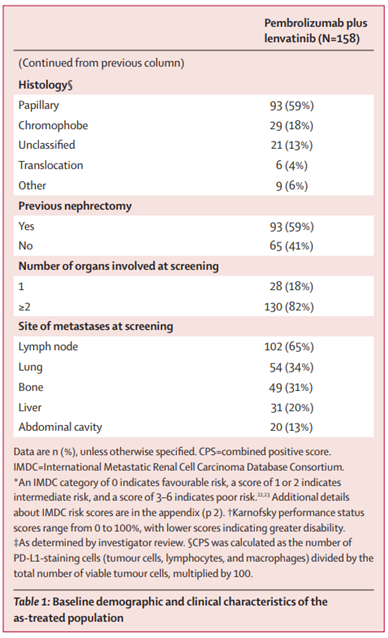
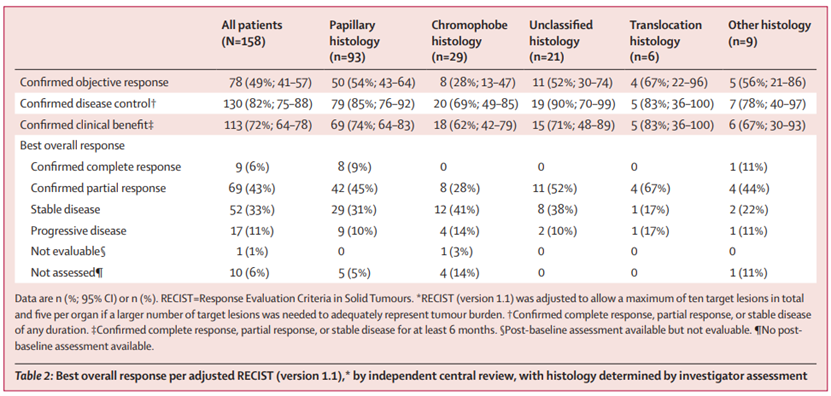
截至数据截止日期(2022年11月7日),中位研究随访期为14.9个月(IQR 11.1-17.4)。158名患者中有78名患者有明确的客观反应(49%;95%置信区间41-57),其中9名患者(6%)有明确的完全反应,69名患者(44%)有明确部分反应。
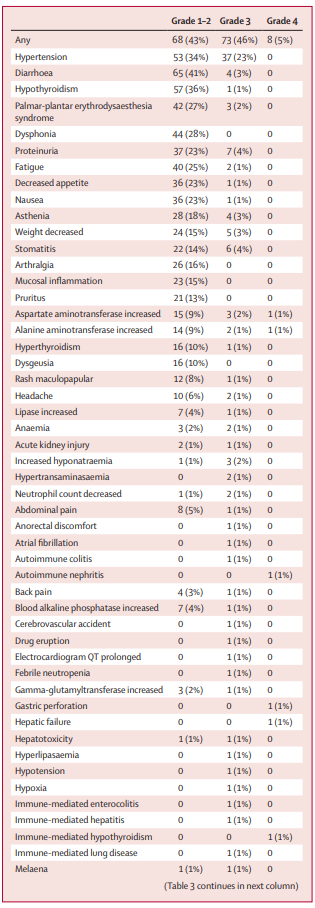
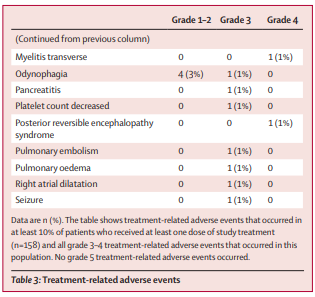
安全性分析:158名患者中有81名(51%)发生了3-4级治疗相关不良事件,其中最常见的是高血压(158名中有37名[23%])、蛋白尿(7名[4%])和口腔炎(6名[4%]])。158例患者中有31例(20%)发生了严重的治疗相关不良事件。8名(5%)患者死于不良事件,研究人员认为这些不良事件均与治疗无关(心力衰竭、腹膜炎、肺炎、败血症、脑血管意外、自杀、肺气肿和肺栓塞各1例)。
结论:帕博利珠单抗加仑伐替尼对既往未经治疗的晚期非透明细胞肾细胞癌患者具有持久的抗肿瘤活性,其安全性与既往研究一致。KEYNOTE-B61的结果支持将帕博利珠单抗联合仑伐替尼作为这些患者的一线治疗选择。
参考文献:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言