浅谈吉兰-巴雷综合征的诊断和治疗
2023-08-27 梅斯神经新前沿 梅斯神经新前沿 发表于上海
根据GBS临床表现、神经电生理学和神经病理学特征,分为急性炎性脱髓鞘性多发性神经病、急性运动轴突性神经病、急性运动感觉轴突性神经病、米勒-费希尔(Miller-Fisher)综合征
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是一种自身免疫性周围神经炎性疾病,以对称性双侧肢体无力、腱反射减弱或消失为主要临床表现,以脑脊液蛋白-细胞分离为特征,病程多呈单程自限性。根据GBS临床表现、神经电生理学和神经病理学特征,分为急性炎性脱髓鞘性多发性神经病、急性运动轴突性神经病、急性运动感觉轴突性神经病、米勒-费希尔(Miller-Fisher)综合征、急性全自主神经病和急性感觉神经病等亚型。除了Miller-Fisher综合征和急性感觉神经病外,其他亚型均可见严重呼吸肌运动障碍导致的呼吸泵衰竭和严重交感-副交感平衡障碍导致的心血管功能紊乱,年患病率为(0.6~1.9)/100000,且无季节差异,其中20%~30%的患者出现呼吸衰竭。
诊断要点
1.急性炎性脱髓鞘性多发性神经病(acute inflammatory demyelinating polyneuropathy,AIDP)是GBS中最常见的类型,又称“经典型GBS”,主要病变为多发神经根和周围神经节段性脱髓鞘。诊断依据如下:
急性起病,进行性加重,2周左右达高峰,常有前驱感染。
对称性肢体、面和咽喉部肌无力;重者呼吸肌无力;腱反射减低或消失。英国医学研究理事会(the UK Medical Research Council,MRC)评分系统(双侧肩外展、前臂屈曲、腕伸展、大腿屈曲、膝伸展、足背屈曲,6组肌群的肌力评分),可用于肌力评估。每组肌力按0~5级评定,评分从0分(完全麻痹)至60分(正常)。
脑脊液检查可见蛋白-细胞分离。
神经电生理检查显示运动神经传导速度减慢,表现为至少2根受检神经存在以下至少1项异常:远端运动潜伏期(distal motor latency,DML)较正常值上限延长25%以上;运动神经传导速度(motor nerve conduction velocity,MNCV)较正常值下限减慢20%以上;F波潜伏期延长20%以上和/或出现率降低等;出现传导阻滞,即近端与远端比,复合肌肉运动电位(compound muscle action potential,CMAP)负相波波幅下降20%以上;异常波形离散(近端与远端比,CMAP负相波时限增宽15%以上)。
病程呈自限性。
2.急性运动轴突性神经病(acute motor axonal neuropathy,AMAN)以广泛的脑神经运动纤维和脊神经前根和运动纤维轴索病变为主,是我国常见类型。诊断依据如下。
急性起病,平均1~2周达高峰;多见于夏秋季,常有前驱感染史(以胃肠道和上呼吸道症状为主)。
表现为肢体对称性弛缓性肌无力,可有脑神经损害症状。
严重者可累及呼吸肌,导致呼吸泵衰竭。
腱反射减弱甚至消失,无感觉及自主神经受损症状。
脑脊液检查可见蛋白-细胞分离。
血清免疫学检查可见脑脊液和血清的抗神经节苷脂抗体阳性(部分患者)。
神经电生理显示感觉神经动作电位(sensory nerve action potential,SNAP)波幅及感觉传导速度(sensory conduction velocity,SCV)正常,MNCV正常或轻度减慢,DML正常或暂时性延长,CMAP波幅明显下降,早期存在传导阻滞(长度依赖性传导障碍,最终演变为轴索变性)。针电极肌电图(electromyography,EMG)表现为早期可见运动单位(motor unit,MU)募集减少,发病1~2周后大量异常自发电位;神经再生特征,如运动单位电位(motor unitpotential,MUP)时限增宽、波幅增高、多相波增多。
病程呈自限性。
3.急性运动感觉轴突性神经病(acute motor sensory axonal neuropathy,AMSAN)以广泛神经根和周围神经的运动与感觉纤维轴索变性为主。诊断依据如下。
急性起病,平均1~2周达高峰。
对称性肢体无力,多数伴有脑神经运动功能受累,重者呼吸肌无力。
感觉障碍,部分出现感觉性共济失调。
自主神经功能障碍常见。
血清免疫学可见抗神经节苷脂抗体阳性(部分患者)。
神经电生理显示除了感觉神经传导测定可见SNAP波幅下降或引不出波形外,其他同AMAN。
4.Miller-Fisher综合征 与经典GBS不同,以眼外肌麻痹、共济失调和腱反射消失为主要临床特点。
急性起病,数日至数周达高峰。
眼外肌瘫痪、共济失调和腱反射减低为主要临床表现,而肢体肌力正常。
脑脊液检查可见蛋白-细胞分离。
血清免疫学检查可见空肠弯曲菌抗体阳性(部分患者)和GQIb抗体阳性(多数患者)。
神经电生理检查显示SNAP波幅下降,感觉传导速度减慢;运动神经传导和EMG正常。
病程呈自限性。
5.急性全自主神经病(acute panantonomic neuropathy,APN)APN以自主神经受累为主,较少见。
急性起病,快速进展,多在2周左右达高峰。
广泛交感和副交感神经功能障碍,表现为视物模糊、畏光、瞳孔散大、对光反应减弱或消失、头晕、直立性低血压、窦性心动过速或过缓、恶心呕吐、腹泻、腹胀,肠麻痹、便秘、尿潴留、勃起功能障碍、热不耐受、出汗少、眼干和口干等。
不伴或伴轻度肢体无力和感觉异常。
脑脊液检查可见蛋白-细胞分离。
病程呈自限性。
排除其他病因。
6.急性感觉神经病(acute sensory neuropathy,ASN)ASN较少见,以感觉神经受累为主。
急性起病,快速进展,多在2周左右达高峰。
对称性肢体感觉异常。
脑脊液检查可见蛋白-细胞分离现象。
神经电生理检查显示感觉神经损害。
病程呈自限性。
排除其他病因。
监测与治疗
GBS主要治疗包括:①尽早在时间窗内(2周内)给予人免疫球蛋白冲击治疗,治疗方法为静脉滴注400mg/(kg.d),1次/d,连续5日,总量2g/kg;②血浆置换治疗,每次交换血浆量40ml/kg或1~1.5倍血浆量,1~2周内3~5次,总量5倍血浆量。
重症GBS患者需要收住神经重症监护病房治疗,以加强心率、呼吸、血压等生命体征和延髓功能相关指标管控,由此降低病死率,改善神经功能预后。
1.呼吸功能管控
一旦出现呼吸泵衰竭,会危及生命,其进展快、病死率高。因此,对呼吸功能的管控是重中之重。
(1)对呼吸肌衰竭的预测:①躁动不安;②心动过速(>100次/min);③呼吸频率>20次/min;④胸锁乳突肌或斜角肌收缩;⑤言语断续;⑥出现反常呼吸;⑦头部大汗。
(2)对气管插管的预测:①发病到人院时间<7日;②咳嗽和站立无力;③肝酶升高;④不能将肘部或头部抬离床面;⑤脑神经受损;⑥抗神经节甘脂抗体阳性;⑦肺活量降低;⑧膈神经的复合肌振幅潜伏期延迟。
(3)对机械通气的预测:Erasmus GBS呼吸功能不全评分(Erasmus GBS respiratoryinsufficiency score,EGORIS)(表-1)可预测GBS患者是否需要机械通气。根据EGORIS评分,将急性期呼吸功能衰竭风险分为高危(5~7分)、中危(3~4分)、低危(0~2分)三组。
表-1 EGORIS评分系统

(4)对呼吸功能指标的管控
1)当PaO₂<60mmHg、PaCO₂>50mmHg时,即刻气管插管和/或机械通气。
2)当予呼吸功能支持时的管控目标:经皮动脉血氧饱和度(SpO₂)>94%;持续呼气末二氧化碳分压35~45mmHg;持续经皮二氧化碳分压40~55mmHg;血气pH7.35~7.45,PaO₂>60mmHg,PaCO₂35~45mmHg,HCO322~27mmol/L。
3)当计划停止机械通气时的评估指征:连续肺功能测试恢复正常、横膈力量提高、排除肺不张或胸腔积液。当肺活量>15ml/kg、最大吸气压力>30cmH₂0,且氧合正常时,尝试减少间歇强制通气率或压力支持水平,以逐渐停止机械通气。
2.心率管控
AMSAN、APN患者常伴有自主神经功能障碍,需常规监测心率。常见的心律失常为持续性心动过速(占25%~38%),轻者无须治疗。严重心律失常可危及生命,如房室传导阻滞或窦性停搏。心率管控的目标为60~100次/min。当心率>100次/min(心动过速)时,可予短效β受体阻滞剂(如拉贝洛尔);当出现心率<60次/min(心动过缓)时,可予阿托品或植入心脏起搏器。心脏阻滞或窦性停搏者,立即心肺复苏,并植入临时心脏起搏器。预测心脏意外事件的指标包括血压、心率显著波动、心电图RR间期变异等。
3.血压管控
GBS常伴阵发性高血压(24%)和直立性低血压(19%),而持续性高血压少见(3%)。当严重高血压(平均动脉压>125mmHg)发作时,可予拉贝洛尔、艾司洛尔或硝普钠。当严重低血压发作时,可予静脉滴注生理盐水(2L),必要时予盐酸米多君或去甲肾上腺素升压治疗。
4.延髓麻痹管控
见于重症GBS,表现为吞咽及咽喉部清洁能力下降,分泌物不易排出或胃液反流,从而引起呛咳和误吸,导致吸人性肺炎,使病情危重。一旦出现延髓麻痹,应采取以下措施:①尽早开始管饲喂养,如果肠内营养不足(胃肠动力障碍或急性胃黏膜损伤伴出血),可启动肠外营养;②强化翻身、拍背、吸痰,防治肺部感染并发症。
5.尿潴留和肠麻痹管控
见于GBS早期,通常给予留置膀胱导尿管解决排尿障碍问题,给予粪便软化剂、灌肠、胃肠减压等缓解排便障碍问题。毒蕈碱激动剂可加重心脏迷走神经超敏反应,因此不建议药物治疗尿便障碍。
预后评估
GBS病死率为4%~15%,神经功能残疾率约为14%,大多为重症GBS。GBS预后评估方法包括:EGORIS、Erasmus GBS预后评分(Erasmus GBS outeome score,EGOS)和改良EGOS(modified EGOS,mEGOS)评分,其通过对年龄、前驱腹泻、有无延髓麻痹或面瘫以及特定时间的肌无力(MRC评分或GBS残疾评分)进行预后评估。
诊治流程
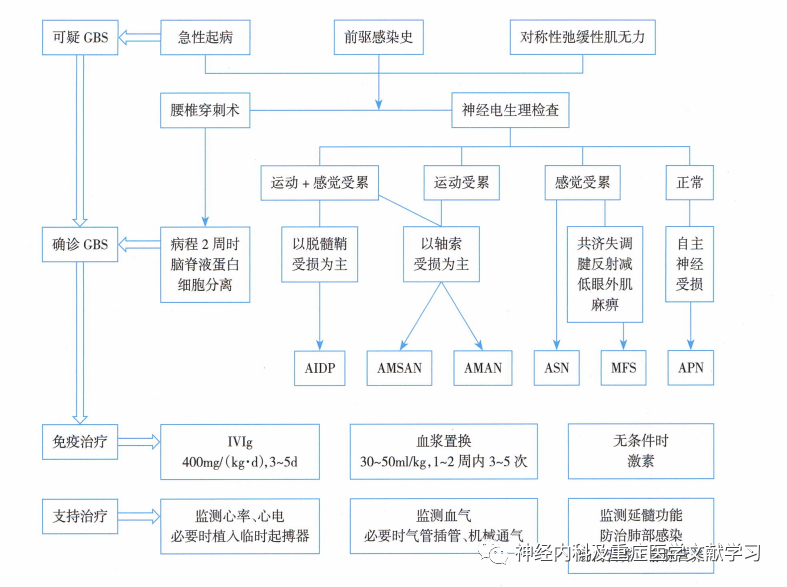
GBS.吉兰-巴雷综合征;AIDP,急性炎性脱髓鞘性多发性神经病;AMSAN.急性运动感觉轴突性神经病;AMAN.急性运动轴突性神经病;ASN,急性感觉神经病;MFS. Miller-Fisher综合征;APN.急性全自主神经病;IVIg,静脉注射免疫球蛋白。
链接:
Erasmus GBS呼吸功能不全评分(EGRIS评分系统)
参考资料 | 神经内科及重症医学文献学习
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#吉兰-巴雷综合征#(Guillain-Barré syndrome,GBS)是一种#自身免疫性周围神经炎性疾病#,以对称性双侧肢体无力、腱反射减弱或消失为主要临床表现,以脑脊液蛋白-细胞分离为特征,病程多呈单程自限性。
124
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是一种自身免疫性周围神经炎性疾病
124
不错,学习了。
0
认真学习了
129
脑脊液检查蛋白细胞分离是GBS的一个特征
139