专访许巧兵教授:淋巴结靶向的LNP-mRNA癌症疫苗,可清除肿瘤并防止复发
2022-08-19 王聪 “生物世界”公众号
该研究开发了一种可高效且特异性靶向淋巴系统的脂质纳米颗粒(LNP),并基于此设计了一种强大且精确的mRNA肿瘤疫苗,从而产生比其他癌症疫苗更有效的反应,能够安全高效地清除小鼠肿瘤,且防止复发。
随着2020年两款mRNA新冠疫苗在对抗初代新冠病毒感染上的优异表现,mRNA疫苗技术吸引了越来越多的关注。
多年来,世界各地的研究人员一直致力于开发针对不同类型癌症的疫苗,但始终收效甚微,获得临床批准的治疗性肿瘤疫苗极为有限。
新冠mRNA疫苗的成功为癌症疫苗的开发带来了新的希望,包括Moderna和BioNTech在内的公司都在推进mRNA癌症疫苗管线。然而,开发一款安全且有效的mRNA癌症疫苗仍然存在着诸多难点。其中,安全高效的递送载体是制约mRNA癌症疫苗研发的一大难题。目前脂质纳米颗粒(LNP)作为一种高效的疫苗递送载体得到了广泛验证,但LNP在肝脏富集的特点,会引起不可忽视的肝部损伤和炎症反应。
因此,开发出一种能够靶向免疫器官的mRNA递送平台,对于开发安全高效的mRNA癌症疫苗至关重要。
2022年8月15日,美国塔夫茨大学许巧兵教授在《美国国家科学院院刊》(PNAS)上在线发表了题为:Lipid nanoparticle-mediated lymph node-targeting delivery of mRNA cancer vaccine elicits robust CD8+ T cell response 的研究论文。
该研究开发了一种可高效且特异性靶向淋巴系统的脂质纳米颗粒(LNP),并基于此设计了一种强大且精确的mRNA肿瘤疫苗,从而产生比其他癌症疫苗更有效的反应,能够安全高效地清除小鼠肿瘤,且防止复发。
这一新的疫苗递送机制不仅可以成为癌症疫苗的通用平台,还可以成为针对病毒和其他病原体的更有效疫苗的通用平台。

许巧兵教授表示,实验室现在正在做的是开发使用脂质纳米颗粒技术递送的下一代mRNA疫苗,它们具有靶向特定器官和组织的能力,其中靶向淋巴系统的mRNA癌症疫苗能够帮助克服当前其他癌症疫苗面临的诸多挑战。
许巧兵的本科和硕士毕业于吉林大学,并在哈佛大学获得博士学位,之后在麻省理工学院 Robert Langer 和 Daniel Anderson 实验室进行博士后训练。2010年,许巧兵加入塔夫茨大学,历任助理教授、副教授,2021年,许巧兵晋升为正教授。多年以来,许巧兵教授一直致力于脂质纳米颗粒(LNP)的开发。
mRNA新冠疫苗使用脂质纳米颗粒(LNP)递送新冠病毒的全长S蛋白的mRNA片段,LNP进入细胞后释放mRNA,mRNA表达出新冠病毒抗原,激活免疫系统。mRNA癌症疫苗的原理类似,只是用mRNA编码在癌细胞中发现的抗原。
迄今为止,已有超过20种mRNA癌症疫苗被纳入临床试验,但这些mRNA大多最终进入了肝脏,虽然mRNA在肝脏细胞中表达的抗原仍能诱导免疫应答,但这存在导致肝脏炎症和损伤的风险。
如果能让这些mRNA更多地靶向B细胞、T细胞等免疫细胞集中的淋巴系统,就能带来更有效更持久的抗肿瘤免疫反应。
此前,许巧兵团队发现通过改变LNP组分的头部化学结构可以影响其递送效果及靶向性,基于这一发现,他们设计了多种具有器官特异性靶向的新型脂质纳米颗粒(LNP),能够向大脑、肝脏、肺等器官特异性递送mRNA,在小鼠模型中治疗遗传疾病。
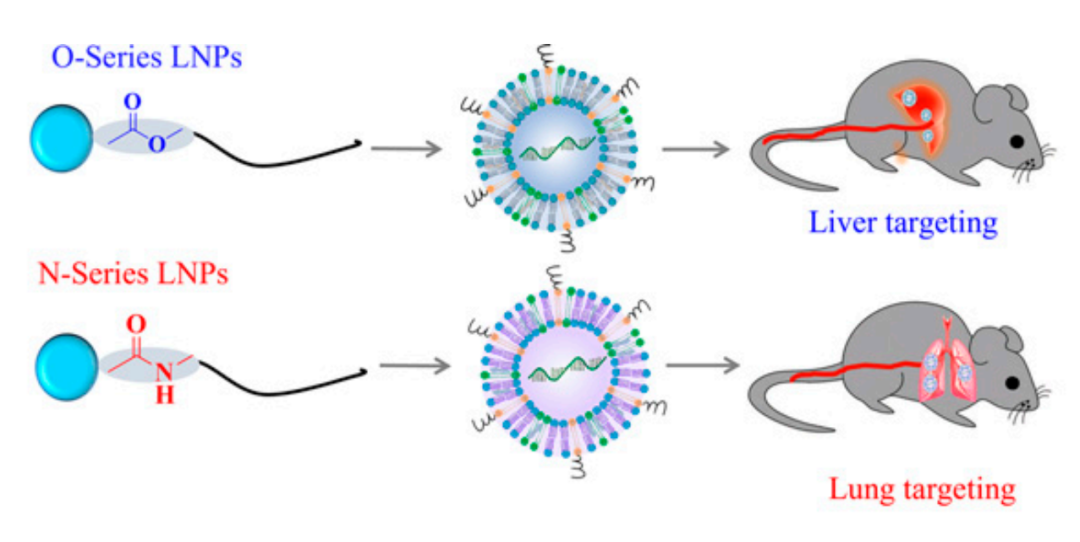
O系列LNPs靶向肝脏,N系列LNPs靶向肺部
在这项最新研究中,研究团队通过河里的脂质分子结构设计,筛选出了一种脂质分子——113-O12B,其能够高度特异性靶向淋巴结。
作为对比,辉瑞/BioNTech的mRNA疫苗使用的脂质分子ALC-0315以1:4的比例分别靶向淋巴结和肝脏,而113-O12B则以3:1的比例分别靶向淋巴结和肝脏。113-O12B表现出增强的淋巴结表达与显着降低的肝脏mRNA表达。进一步的淋巴结亚细胞分析显示,113-O12B可以将mRNA递送到约30%的抗原呈递细胞中,显着强于ALC-0315。
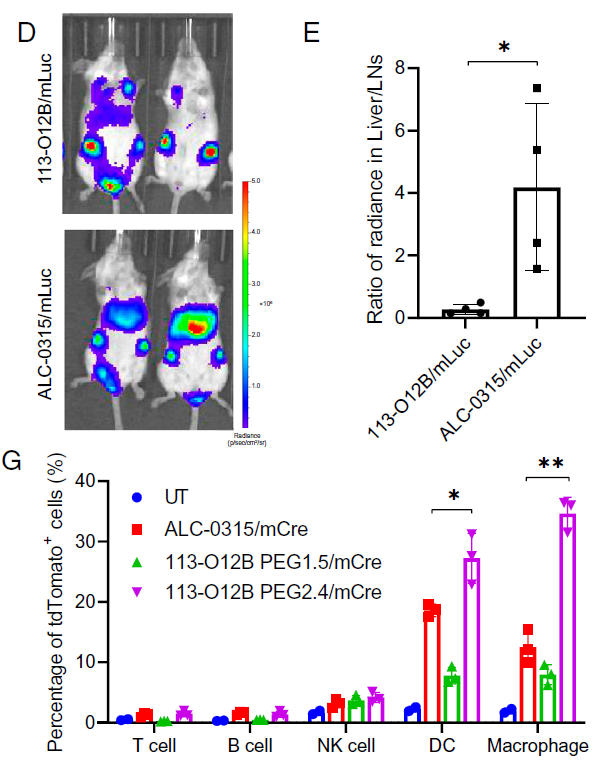
图1,淋巴结靶向的mRNA递送
许巧兵教授解释道:淋巴系统,包括我们熟悉的在感染期间经常肿胀的淋巴结,是疫苗的重要目标,因为这是获得针对外来抗原或癌症抗原的免疫力的地方。如果将人体视为对抗病毒、细菌、寄生虫和肿瘤的“战场”,而B细胞和T细胞等免疫系统是“士兵”,那么淋巴结就是训练B细胞和T细胞以更有效对抗“敌人”的“新兵训练营”。
接下来,研究团队采用卵白蛋白(OVA)作为模型抗原,分析了编码OVA的mRNA疫苗在体内的免疫激活效果。发现113-O12B表现出与ALC-0315相当的抗体激活水平与增强的CD8+T细胞激活能力。所有接种过OVA mRNA疫苗的小鼠都预防了OVA稳转B16F10(B16F0-OVA)细胞的皮下肿瘤的生成。并在30天后,完全阻止了肺部黑色素瘤转移模型的生成。
研究团队进一步分析了接种该mRNA疫苗对于肿瘤免疫细胞成分的影响。结果表明,接种mRNA疫苗可以增强肿瘤组织的免疫细胞浸润,并逆转肿瘤组织免疫抑制微环境,促进巨噬细胞M1型极化。此外,联用PD-1抗体进一步增强了治疗效果。
最后,研究团队评估了该mRNA疫苗作为治疗性疫苗对已形成的肿瘤的抑制能力。分别采用了全长OVA或者肿瘤特异性多肽TRP2180-188作为抗原,用B16F10-OVA或B16F10细胞作为肿瘤模型。
令人振奋的是,在上述两个体系中,113-O12B都显着抑制了肿瘤生长。在联合PD-1抗体疗法后,2只小鼠(40%)实现了肿瘤完全缓解。
此外,完全缓解的小鼠在随后注射转移性肿瘤细胞后都能阻止任何新肿瘤的形成,这表明该mRNA肿瘤疫苗产生了长效免疫记忆效果。
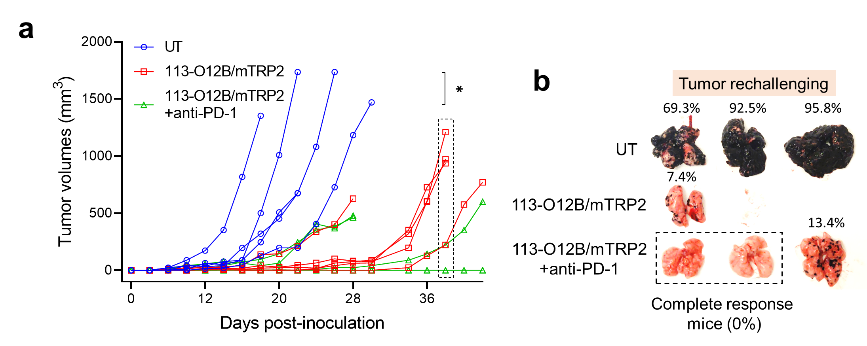
图2,113-O12B/mTRP2疫苗的抗肿瘤治疗效果
综上所述,该研究开发了一种具有淋巴结特异性mRNA表达的疫苗递送平台——113-O12B,该平台具有显著的淋巴结mRNA表达与降低的肝部mRNA表达效果,可以有效地实现蛋白类和多肽类抗原的装载与递送,并取得了优异的肿瘤预防和治疗效果,还产生了长效记忆效应以阻止肿瘤复发。
最后,论文的第一作者陈进进博士表示,癌症疫苗一直是个挑战,因为肿瘤抗原不像病毒或细菌上的抗原那样看起来是外来的,而且肿瘤会主动抑制免疫反应。而这项研究开发的癌症疫苗能够携带肿瘤抗原的mRNA,从而引起更强的免疫反应。它不仅可以成为一个通用的癌症疫苗平台,还可以发展为针对病毒以及其他病原体的预防性通用疫苗平台。
塔夫茨大学的博士后陈进进与叶忠峰为该论文的共同第一作者,陈进进博士现已经全职加入中山大学孙逸仙纪念医院。
许巧兵教授近年来致力于开发器官和组织特异性LNP递送载体,通过化学方法调整LNP的结构,实现了LNP向肝外器官(例如肺、脾脏)的特异性靶向。基于这些研究成果,许巧兵教授创立了 Hopewell Therapeutics,致力于将新型器官特异性靶向LNP用于肿瘤免疫治疗、基因治疗和基因编辑治疗。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#专访#
98
#淋巴结#
122