Autophagy:武汉大学付碧石团队揭示AP3B1促进调节狂犬病毒糖蛋白选择性降解和病毒进入的作用机制
2024-08-31 iNature iNature 发表于上海
该研究中,亲和标签纯化质谱法被用于描述RABV糖蛋白和宿主蛋白的相互作用,并且PDIA3/ERP57被鉴定为RABV感染的潜在抑制剂。
狂犬病毒每年在全球造成约59,000人死亡,因此需要开发有前景的治疗方法。
2024年8月17日,武汉大学付碧石团队在Autophagy 在线发表题为“AP3B1 facilitates PDIA3/ERP57 function to regulate rabies virus glycoprotein selective degradation and viral entry”的研究论文。该研究中,亲和标签纯化质谱法被用于描述RABV糖蛋白和宿主蛋白的相互作用,并且PDIA3/ERP57被鉴定为RABV感染的潜在抑制剂。
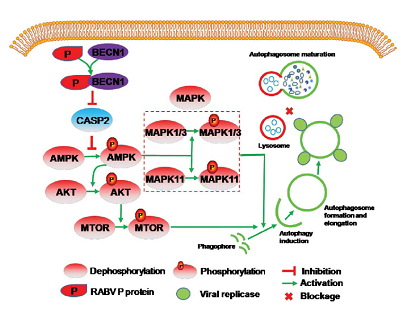
PDIA3通过以下机制限制RABV感染:PDIA3通过选择性巨自噬/自噬途径靶向赖氨酸332介导RABVG蛋白的降解;PDIA3相互作用蛋白AP3B1(衔接子相关蛋白复合物3亚基β1)在PDIA3引发的G蛋白选择性降解中是必不可少的;此外,PDIA3竞争性地与NCAM1/NCAM(神经细胞粘附分子1)结合以阻断RABVG,阻止病毒进入宿主细胞。与RABVG蛋白结合的PDIA3190-199aa残基是防御RABV的必要和充分条件。这些结果证明了针对PDIA3或利用PDIA3190-199aa肽治疗临床狂犬病的生物制剂的治疗潜力。

狂犬病毒的特征是子弹状病毒颗粒,可导致致命的脑炎,全球每年约有40,000-70,000人因此死亡。由于缺乏有效的治疗方法,狂犬病的死亡率接近100%。RABV属于弹状病毒科的狂犬病毒属,其负向RNA基因组长约12kb,编码五种蛋白质:核蛋白、磷蛋白、大聚合酶蛋白、基质蛋白和糖蛋白(G)。RABV劫持细胞因子以逃避抗病毒防御并促进病毒复制的机制仍不清楚。鉴于蛋白质-蛋白质相互作用(PPI)在病毒感染和发病机制中的重要性,利用小分子或生物疗法靶向蛋白质相互作用组为抗病毒药物提供了潜在的途径。神经细胞中的RABV宿主PPI仍然很大程度上未知。因此,绘制RABV-宿主相互作用组图并阐明宿主因子调控RABV感染的机制至关重要。
RABVG是病毒体表面的主要病毒蛋白,形成三聚体刺突,对于受体结合、病毒进入、随后的组装和新病毒颗粒的出芽至关重要。先前的研究表明,宿主因子对G蛋白的细胞内降解可抑制RABV感染。尽管如此,了解G蛋白与宿主因子的相互作用(利用细胞环境促进病毒复制和免疫逃避)仍然不够。阐明RABVG-宿主PPI并筛选关键宿主因子是一种有前途的抗病毒策略。PPI绘图为寨卡病毒、流感病毒(IAV)和扎伊尔埃博拉病毒(EBOV)的生命周期提供了重要的见解。先前的研究使用纳米LC-MS/MS在纯化的成熟RABV颗粒中鉴定了49种与病毒颗粒相关的宿主蛋白,表明它们可能参与病毒复制和组装。然而,对不同菌株RABV-宿主PPI的了解并不完整,并且RABVG蛋白如何操纵宿主细胞功能有待充分阐明。
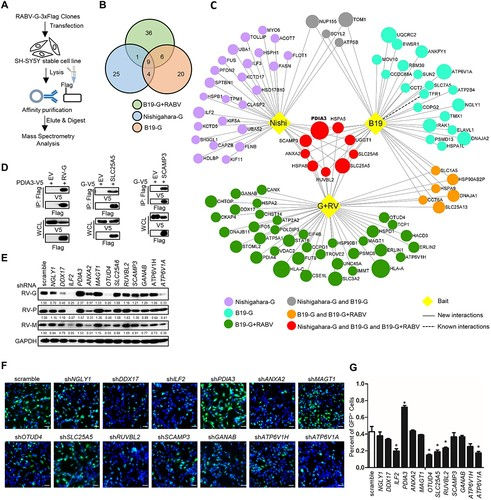
AP-MS实验确定了抑制RABV感染的候选药物(图源自Autophagy )
在本研究中,作者生成了不同菌株的RABVG宿主PPI图谱,并确定了限制RABV感染的PDIA3/ERP57。PDIA3属于蛋白质二硫键异构酶家族,其特征在于含有Cys–X–X–Cys序列的硫氧还蛋白样结构域。PDIA3包含四个结构域(α、β、β'和α'),表现出硫氧还蛋白样折叠活性。α和α'结构域含有一个硫氧还蛋白样活性位点,该位点具有C-G-H-C基序,赋予PDIA3的氧化还原特性。PDIA3主要在蛋白质折叠中发挥作用,催化二硫键的形成和重塑。目前,多项研究揭示了PDIA3在病毒性传染病中的多种作用。在细胞表面,PDIA3被证明可以促进IAV和IBV进入A549细胞并在其内复制。另一项研究表明,PDIA3促进乙肝病毒进入体内并具有感染性。此外,据报道,PDIA3还通过靶向半胱氨酸残基触发EBOVG蛋白的错误折叠,促进自噬-溶酶体途径降解。然而,PDIA3防御RABV的机制仍不清楚。
为了研究PDIA3如何与细胞内在成分协同抑制RABV感染,建立了PDIA3-宿主蛋白的综合相互作用组图谱。AP3B1被确定为PDIA3结合伙伴,以介导其抗RABV活性。AP-3复合物被网格蛋白包裹,在晚期高尔基体/反高尔基体网络和/或内体中的蛋白质分选中发挥重要作用。它调节溶酶体相关细胞器的形成和成熟,参与将某些溶酶体膜蛋白(包括LAMP1、LAMP2、SCARB2/LIMP-2和CD63)运输到溶酶体。大量研究表明,宿主抗病毒蛋白通过选择性机制激活货物特异性自噬,从而降解病毒蛋白并抑制病毒感染。然而,PDIA3利用AP3B1进行蛋白质分选和货物特异性自噬以抑制RABV感染的机制仍然不太清楚。在这项工作中,我们说明了PDIA3募集AP3B1通过选择性自噬降解RABVG蛋白并阻止病毒进入。我们还验证了PDIA3190-199aa残基对于RABVG蛋白选择性降解和RABV有效进入至关重要。综上所述,这些发现揭示了PDIA3和AP3B1在RABV感染中的细胞内在功能,并为开发狂犬病治疗铺平了道路。
参考消息:
https://www.tandfonline.com/doi/full/10.1080/15548627.2024.2390814#abstract
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









太厉害了,👍👍👍👍👍👍👍👍👍
29
#狂犬病毒# #AP3B1#
67