君实抗TIGIT单抗临床试验申请获批准,全球各大玩家忙布局最快明年上市
2021-01-28 JACKZHAO MedSci原创
1月27日,君实生物重组人源化抗TIGIT单克隆抗体注射液的临床试验申请已于近日获得国家药品监督管理局批准。
1月27日,据梅斯医学了解到,君实生物自主研发的重组人源化抗TIGIT单克隆抗体注射液(项目代号:JS006)的临床试验申请已于近日获得国家药品监督管理局批准。
JS006是君实生物自主研发的重组人源化抗TIGIT单克隆抗体注射液。临床前研究结果表明,JS006可特异性阻断TIGIT-PVR抑制通路,刺激杀伤性免疫细胞活化,分泌肿瘤杀伤性因子。
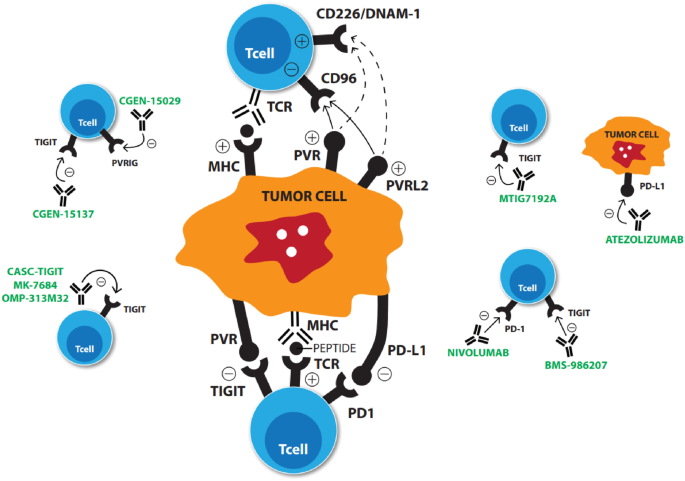
TIGIT(T cell immunoglobulin and ITIM domain,T细胞免疫球蛋白和TIIM结构域)是新兴的NK细胞和T细胞共有的抑制性受体,可与肿瘤细胞上高表达的PVR受体相互结合,介导免疫反应的抑制信号,从而直接抑制NK细胞和T细胞对肿瘤细胞的杀伤作用,效果类似于PD-1对T细胞的抑制作用。
TIGIT可通过三种不同的作用机制抑制淋巴细胞:

- TIGIT可以在结合PVR后通过其细胞内尾部的ITIM和/或ITT基序发出信号(上图左)。
- TIGIT可通过与PVR结合诱导相邻树突细胞或肿瘤细胞中的PVR信号传导(上图中)。
- TIGIT可以通过以更高的亲和力结合PVR或破坏CD226同型二聚化来抑制CD226信号传导。
多项临床前的试验结果显示抗TIGIT抗体与抗PD-1/PD-L1抗体可发挥协同抗肿瘤作用。两者结合是一种有前途的抗癌治疗策略,有望增加患者对免疫治疗的反应,扩大可能受益人群的范围。
而就在今年年初,美国食品药品监督管理局(FDA)已授予领跑者罗氏公司TIGIT单抗tiragolumab突破性疗法资格(BTD)认定,用于与阿斯利康的PD-L1抑制剂Tecentriq(atezolizumab)联合用于一线治疗转移性非小细胞肺癌(NSCLC)患者,这些患者的PD-L1高表达且无EGFR或ALK基因组肿瘤异常。Tiragolumab是一种单克隆抗体,旨在与TIGIT(免疫细胞上的蛋白质受体)结合,可潜在地增强人体的免疫反应,从而起到免疫放大作用。通过与TIGIT结合,tiragolumab阻断了它与一种称为脊髓灰质炎病毒受体(PVR或CD155)的蛋白的相互作用,该蛋白可以抑制人体的免疫反应。对TIGIT和PD-L1的阻断可以协同使T细胞重新活化并增强NK细胞的抗肿瘤活性。
我国进展也较快推进,去年8月25日,中国国家药监局药品审评中心(CDE)就已公示,罗氏(Roche)旗下靶向T淋巴细胞TIGIT靶点的单抗Tiragolumab获批临床试验默示许可,该药在全球目前已经进入III期临床研究,此次首次在国内获批,将使国内患者直接受益,加速该治疗模式在中国落地。
Tiragolumab是第一个获得FDA批准BTD的抗TIGIT分子,其命名基于II期CITYSCAPE试验的随机数据,罗氏曾在ASCO 2020大会上以口头报告形式公布了该试验的完整性结果。
据悉,目前已有多家公司参与其中TIGIT相关产品的研发,国内百济君实等可能最快明年就可以看到相关产品上市。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








如果抗tigit单抗成功上市且价格平民,将是历史性的革新
113
生物技术很火
104