好文推荐 | A型肉毒毒素与CGRP单克隆抗体药物治疗慢性偏头痛的研究进展
2024-01-25 中风与神经疾病杂志 中风与神经疾病杂志 发表于陕西省
本文进行了综述,以评价和总结这些药物用于成人CM预防性治疗的有效性和安全性。
摘要
以往研究表明,A型肉毒毒素可显著降低慢性偏头痛患者的头痛频率、头痛强度和头痛相关的功能障碍。近年来发现靶向降钙素基因相关肽(CGRP)通路的多个单克隆抗体也可以显著改善慢性偏头痛患者的临床转归。目前尚缺乏二者预防性治疗慢性偏头痛的对比研究。本文重点介绍A型肉毒毒素和靶向CGRP及其受体单抗[CGRP(r)mAb]治疗慢性偏头痛的疗效和安全性,及A型肉毒毒素疗效不足的患者转换为CGRP(r)单抗治疗后的转归,为临床治疗选择提供借鉴。
偏头痛是一种常见的慢性且高度致残的疾病,根据2019年的“全球疾病负担研究”报告,偏头痛被列为导致残疾损失寿命(years lived with disability)的第二大因素。国际头痛疾病分类第三版(The International Classification of Headache Disorders,3rd edition,ICHD‑3)定义慢性偏头痛(chronic migraine,CM)为每月头痛发作至少15 d并持续不少于3个月,且每月头痛性质为偏头痛的天数不少于8 d。2016年全球疾病负担研究发现偏头痛全球患病率约为14%,慢性偏头痛占所有偏头痛的2%~8%。CM使患者在个人、家庭、工作、社会和经济水平产生显著的负面影响,导致生活质量下降。
偏头痛的发病机制目前尚不清楚。有部分证据支持偏头痛起源于外周三叉神经传入纤维的激活和敏化,脑膜血管舒张、神经源性炎症和中枢敏化的激活最终导致头痛症状,其中多种神经肽参与了这一过程。目前较公认的观点是,皮质扩散性抑制(cortical spreading depression,CSD)参与偏头痛的先兆发生,并促进多种血管活性物质的释放,例如P物质和降钙素基因相关肽(calcitonin gene-related peptide,CGRP)等,导致神经源性炎症,进一步激活三叉神经血管系统。随着反复持续的激活,三叉神经元敏化,刺激阈值降低,对刺激反应增加,即外周敏化。敏化扩散到三叉神经脊束核的神经元及丘脑时引起痛觉超敏。痛觉超敏是偏头痛进展的临床表现。
CM的管理重点是预防性治疗,以减少头痛频率和严重程度,并限制对急性治疗药物的依赖。传统的用于预防治疗CM的传统口服药物包括抗高血压药、抗抑郁药和抗惊厥药。然而,这些治疗措施的依从性往往很低,81%的患者在第1年的治疗间隔时间超过90 d,大约2/3的患者在第1年后停止治疗。口服预防性抗偏头痛治疗在相当比例的患者中无效的原因是多方面的。不同的患者对药物的吸收、代谢和反应可能存在差异,导致治疗效果存在不确定性。某些患者可能对口服药物产生耐药现象,导致药物逐渐失效。口服药的副作用也是导致治疗不持续的常见原因,如恶心、头晕和疲劳等。对治疗计划的依从性不佳也可能是口服药物无效的原因之一。
除了传统的口服药物之外,近几年偏头痛的预防治疗有了新的进展。新的药物包括A型肉毒毒素和针对CGRP或其受体(CGRPr)的单克隆抗体(mAb),这些药物具有治疗CM患者的高质量临床研究证据,在美国和欧盟也都获得了批准。目前已经有4种CGRP抗体药物上市或批准,分别是艾普奈珠单抗、依瑞奈尤单抗、瑞玛奈珠单抗和加卡奈珠单抗。
虽然A型肉毒毒素和CGRP单克隆抗体在各种临床试验中显示出良好的疗效和较低的不良反应,但是人们对这些治疗方法在现实世界中的有效性和安全性知之甚少。因此,我们进行了综述,以评价和总结这些药物用于成人CM预防性治疗的有效性和安全性。
1 A型肉毒毒素在CM预防性治疗的疗效与
安全性
A型肉毒毒素是一种神经毒素,可通过阻断神经递质释放来缓解疼痛。在慢性偏头痛预防中,A型肉毒毒素可能通过抑制三叉神经末梢释放CGRP,从而降低疼痛敏感性。目前,多项研究表明,A型肉毒毒素可显著降低慢性偏头痛患者的头痛频率、头痛强度和头痛相关的功能障碍。
评估A型肉毒毒素疗效的研究各不相同,研究中的注射部位和各自的单位都不同,剂量从100单位到195单位不等。在3项预防性治疗CM的随机对照研究中,Sandrini等的研究中患者接受了16次肌肉注射,Pijpers等和Silberstein等的研究中患者按照PREEMPT注射范式 接受了31个注射部位的固定剂量注射,涉及7个特定的头颈部肌肉区域。3项研究都将基线开始前4周内使用任何预防性药物以及之前接触过任何A型肉毒毒素作为排除标准。Sandrini等的受试者在接受A型肉毒毒素治疗前进行了为期8 d的停药治疗,Pijpers等则指导受试者在治疗期间停用任何急性药物,而Silberstein等则未明确是否改变急性药物的使用。
3项研究共纳入1 151例受试者,平均年龄45.7岁,女性占比为80.9%,其中1 139例受试者报告了每月头痛天数的变化,并被纳入研究分析。Sandrini的研究结果显示,A型肉毒毒素组的患者每月头痛天数相较于安慰剂组减少了2.6 d;Silberstein的研究结果显示A型肉毒毒素组的患者每月头痛天数相较于安慰剂组减少了2.0 d,两项研究均观察到A型肉毒毒素组有更高的至少50%的缓解率。而在Pijpers研究中,每月头痛天数减少1.2 d,与安慰剂组相比未观察到缓解率差异。与安慰剂组相比,A型肉毒毒素组的不良事件(AE)发生率没有显著差异。最常见的不良事件是注射部位疼痛、注射部位血肿和肌肉无力。
目前,A型肉毒毒素在慢性偏头痛预防中的研究仍处于早期阶段,主要集中在A型肉毒毒素的疗效和安全性上,对于其作用机制以及长期使用的效果还需要进一步探索。大多数研究纳入的患者年龄范围较窄,未对其他类型的偏头痛进行研究。未来的研究可以扩大样本规模,并纳入其他类型的偏头痛患者,以验证结果的稳定性和普适性。
2 CGRP(r)mAbs药物在CM预防性
治疗的疗效与安全性
降钙素基因相关肽(CGRP)是一种神经肽,在偏头痛发作中起着重要作用。CGRP可通过扩张血管、激活三叉神经和促进炎症反应等机制来诱发偏头痛。CGRP抗体药物通过阻断CGRP受体与CGRP结合,抑制神经元的活动和CGRP对血管和痛觉的影响,从而有效预防和减轻偏头痛的发作。
在4种CGRP(r)mAbs药物预防性治疗CM的随机对照试验中,所有试验均设置两个剂量组和安慰剂对照组,依瑞奈尤单抗、瑞玛奈珠单抗、加卡奈珠单抗为每月进行一次皮下注射,艾普奈珠单抗为每12周一次静脉注射。所有研究均排除了在基线期前接受A型肉毒毒素治疗至少4个月的患者。 另外,瑞玛奈珠单抗HALO研究、加卡奈珠单抗REGAIN研究和艾普奈珠单抗PROMISE-2研究允许在试验期间服用口服预防药物(托吡酯或普萘洛尔),其中HALO研究允许30%的患者使用额外的预防药物。评估依瑞奈尤单抗的2项研究在研究期间和基线开始前两个月禁止使用任何预防药物。在整个试验过程中,允许患者根据需求服用急性头痛药物,但阿片类药物和巴比妥类药物的使用仅限每月不超过3~4 d。
目前4种CGRP(r)mAbs均可显著降低慢性偏头痛患者的头痛频率、头痛强度和头痛相关的功能障碍(见表1)。在最高剂量下每个月的偏头痛天数(monthly migraine days,MMDs)变化情况,依瑞奈尤单抗相较于基线减少6.6 d,瑞玛奈珠单抗相较于基线减少5.2 d,加卡奈珠单抗相较于基线减少4.8 d,而艾普奈珠单抗相较于基线减少8.6 d。最高剂量下慢性偏头痛患者的≥50%缓解率和安慰剂组相比均有显著差异,艾普奈珠单抗为61.4%,依瑞奈尤单抗为41.2%,瑞玛奈珠单抗为37.6%,加卡奈珠单抗为27.5%。
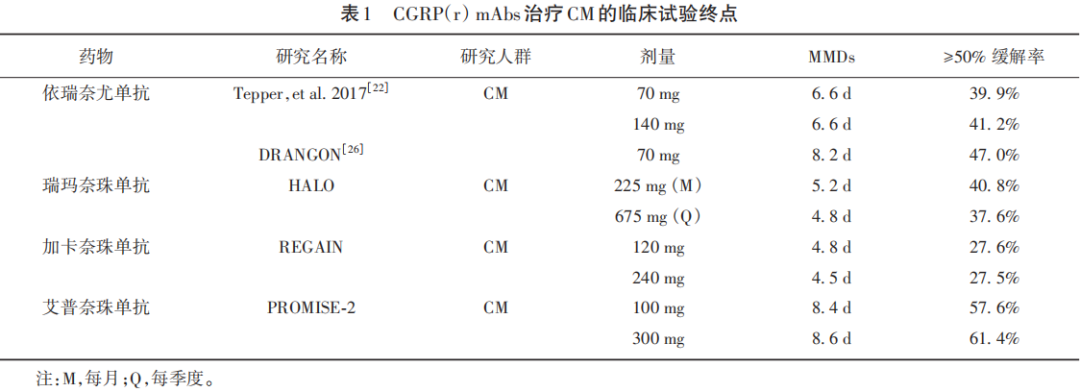
在伴药物过度使用(medication overuse,MO)或药物过度使用性头痛(medication overuse headache,MOH)偏头痛患者的≥50%缓解率(%)中,同样观察到最高剂量组与安慰剂组间的显著差异(见表2),艾普奈珠单抗为61.9%,依瑞奈尤单抗为35.0%,瑞玛奈珠单抗为34.8%,加卡奈珠单抗为27.4%。
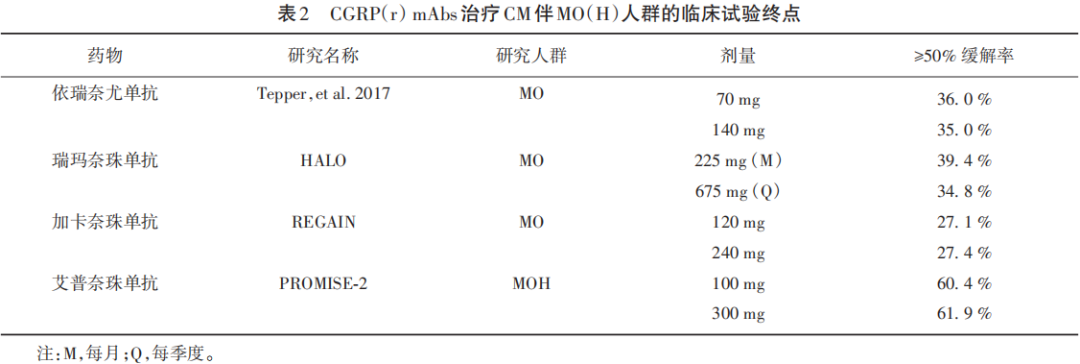
在评估CGRP(r) mAbs对既往治疗失败的偏头痛患者的疗效和安全性的研究中,尽管不同研究中的患者特征有所不同[LIBERTY、FOCUS、CONQUER和DELIVER中分别为100%发作性偏头痛(episodic migraine,EM)、61% CM、42% CM和46% CM],但所有这些治疗3个月的试验都显示了抗CGRP(r) mAb的优越性。最高剂量下慢性偏头痛患者的≥50%缓解率,艾普奈珠单抗为50.0%,依瑞奈尤单抗为30.0%,瑞玛奈珠单抗为34.0%,加卡奈珠单抗为38.0%。
总体不良事件发生率从43.3%到68.3%不等,退出率从1.5%到2.5%不等。与安慰剂相比,较低剂量CGRP mAb中的AE频率没有显著差异。最常见的不良事件包括注射部位反应,如疼痛、红斑、硬结、出血、鼻咽炎等感染、上呼吸道感染、鼻窦炎、尿路感染、肌肉痉挛、背痛和疲劳。同时,一项荟萃分析旨在评估靶向CGRP通路预防性治疗的安全性与耐受性,纳入19项3期研究,14 584例偏头痛患者。与安慰剂相比,接受艾普奈珠单抗100 mg和300 mg治疗的患者治疗期间出现的不良事件(treatment emergent adverse events,TEAE)和严重不良事件(serious adverse events,SAE)的发生率最低。
在依瑞奈尤单抗真实世界研究中,27%~88%的患者报告MMDs减少了50%。很大一部分患者(30%~94%)需要剂量升级,表明依瑞奈尤单抗140 mg的疗效更高。因疗效不佳和不良事件而中断治疗的比例分别为0%~22%和0%~12%。同时报告显示,22%~83%的患者从CM转为EM 。一项为期12周的瑞玛奈珠单抗多中心开放标签研究中,CM患者的50%缓解率为58%。在一项为期6个月的加卡奈珠单抗多中心研究中,既往接受过3次或3次以上预防性治疗失败的CM患者MMDs减少 50%的比例为64%。一项回顾性研究报告了艾普奈珠单抗治疗发作性和慢性偏头痛的真实世界有效性和安全性。研究纳入了100例被诊断为发作性或慢性偏头痛的成年患者,25例患者符合慢性偏头痛(CM)标准。所有参与者基线每月偏头痛天数为12.23 d,到第6个月降至3.66 d;其中,CM患者每月偏头痛天数从15.56 d降至4.76 d,58.49%的参与者在第6个月时每月偏头痛天数降低75%以上。且艾普奈珠单抗耐受性良好,只有1例不良事件导致研究中止。
3 A型肉毒毒素与CGRP(r)mAbs药物之间的转换治疗
临床实践中,评估因疗效不佳而从A型肉毒毒素转换为抗CGRP(r)mAbs治疗的患者对这两种药物的临床反应尤为重要。Luigi等的研究纳入对几种预防性治疗方法耐药的CM患者,这些患者首先接受A型肉毒毒素治疗,然后转换为抗CGRP(r)mAbs治疗,在各自的基线之前有两个为期9个月的观察阶段。对所有患者的保留率和两种疗法的有效性进行了评估。在78例入组患者中(80.8%为女性,89.7% 基线时患伴有MO),32例接受了依瑞奈尤单抗治疗,32 例接受了加卡奈珠单抗治疗,14例(18.0%)接受了瑞玛奈珠单抗治疗。治疗3个月和9个月时,A型肉毒毒素的患者保留率分别为91.0%和62.2%,抗CGRP mAbs的保留率分别为96.2%和76.9%。治疗9个月时,接受A型肉毒毒素和抗CGRP mAbs患者的≥50%缓解率分别为22.4%和 65.0%。抗CGRP mAbs可减少MHD(每月头痛天数)、AMN(镇痛药物绝对数量)和AMD(镇痛药物使用天数),并在9个月时减少MO患者的数量。在对A型肉毒毒素缓解率<50%或<30%的分层患者中,抗CGRP的9个月时≥50%的缓解率分别为62.9%和57.9%。没有SAEs记录,只有2例患者因AEs而中断治疗。对难治的CM患者停用A型肉毒毒素并接受抗CGRP mAb治疗在偏头痛相关的临床结果方面有很大改善,对于使用A型肉毒毒素前2个周期疗效不佳的患者,改用抗 CGRP mAb治疗似乎是一个可行的潜在方案。
目前还没有关于不同类别CGRP(r)mAbs疗效对比的数据,从抗CGRPr mAb转换到抗CGRP mAb的情况比较常见。一项真实世界的回顾性研究报告称,32%的依瑞奈尤单抗无应答者在改用加卡奈珠单抗或瑞玛奈珠单抗后,每月头痛天数出现了有临床意义的下降(30%),12%的患者达到了50%的缓解率。但每天持续头痛的患者并没有从转换疗法中获益。一些病例报告也显示,对依瑞奈尤单抗治疗失败的患者转用加卡奈珠单抗后头痛天数减少。疗效差异的一个可能解释是偏头痛存在不同的亚型,在这些亚型中,淀粉样蛋白、肾上腺髓质素和垂体腺苷酸环化酶激活多肽等其他神经肽可能起主导作用。这些数据表明,从CGRP(r)mAb转换到CGRP mAb是一种可行的治疗方案。
除了作用部位的差异外,支持在抗CGRP(r)mAb之间转换的考虑因素还包括剂量增加的机会(依瑞奈尤单抗70 mg到140 mg)、给药计划的差异(每月一次还是每季度一次)以及制剂的差异(皮下注射还是静脉注射)。艾普奈珠单抗是唯一一种静脉注射的抗CGRP mAb,可在数分钟至数小时内达到最大血清浓度,而其他抗体则需要1周才能达到最大浓度。
4 讨论与总结
A型肉毒毒素的3项随机对照研究均报告头痛频率较基线有所降低,但其中两项研究(Sandrini等和 Pijpers等)的结果不显著,可能是样本量较小。此外,各研究的50%缓解率也不一致。Pijpers等的研究显示,安慰剂组的50%缓解率偏高,可能是因为安慰剂组在额叶区域注射了17.5单位的A型肉毒毒素,以及抑郁症可能会降低CM患者的50%缓解率。Silberstein等的研究受试者接受了两个治疗周期,而其他两个研究均接受了一个A型肉毒毒素治疗周期,因此受试者可能会从第二剂A型肉毒毒素治疗中获益。研究次要终点[包括健康相关生活质量 (HRQoL)、HIT-6评分、MIDAS评分、药物过度使用状态的变化]方面,除Pijpers等的研究外,其他两项研究观察到接受A型肉毒毒素治疗的患者有明显的好转趋势。对于4种CGRP(r)mAb纳入的研究均表明,在所有评估的主要结果方面,治疗组无论高剂量还是低剂量,都具有明显的统计学优势。艾普奈珠单抗即使在达到75%缓解率方面也比安慰剂更有优势(30% vs 15%)。同时,CGRP(r)mAbs在MSQoL评分、HIT-6评分和MIDAS总分与基线相比也显示出临床变化。
一项回顾性病例研究检验针对A型肉毒毒素治疗的CM患者添加CGRP mAbs治疗的疗效和耐受性。A型肉毒毒素和CGRP mAbs联合治疗的目的是通过靶向不同的神经元纤维来发挥作用。A型肉毒毒素主要作用于无髓纤维(C-fibers),抑制神经递质(如CGRP)的释放,从而预防疼痛信号的传输。而CGRP mAbs则主要作用于薄髓纤维(Ad-fibers),进一步减少CGRP的释放。研究发现,对于CM患者,在A型肉毒毒素治疗中添加CGRP mAbs可进一步减少每个月的头痛天数(monthly headache days,MHD),并且没有出现重大耐受性问题。尽管如此,这种联合治疗的疗效和耐受性仍需要进一步评估。
迄今为止,尚未发表过对CGRP(r)mAbs和A型肉毒毒素进行直接比较的文章,其部分原因是此类研究难以做到盲法。对于CM并伴有MOH的患者,A型肉毒毒素和CGRP(r)mAb在疗效上存在部分差异。在减少头痛或偏头痛天数方面,A型肉毒毒素和CGRP(r)mAbs的疗效均高于安慰剂,但接受CGRP mAbs 治疗的患者的50%缓解率更高。与A型肉毒毒素相比,CGRP(r)mAbs的退出率更低,与安慰剂相比,A型肉毒毒素与CGRP(r)mAbs均未发现明显的不良事件。对于A型肉毒毒素治疗失败或不耐受的难治偏头痛患者可能会从CGRP(r)mAbs治疗或联合治疗中获益,以及不同CGRP(r)mAbs间的转换治疗也为这部分患者提供了更多的治疗选择。
参考文献
[1]Steiner TJ,Stovner LJ,Jensen R,et al.Migraine remains second among the world's causes of disability,and first among young women:findings from GBD2019[J].J Headache Pain,2020,21(1):1-4.
[2]GBD 2016 Neurology Collaborators.Global,regional,and national burden of neurological disorders,1990-2016:a systematic analysis for the Global Burden of Disease Study 2016[J].Lancet Neurol,2019,18(5):459-480.
[3]Leonardi M,Raggi A.A narrative review on the burden of migraine:when the burden is the impact on People's life[J].J Headache Pain,2019,20(1):41.
[4]Ashina M,Hansen JM,Do TP,et al.Migraine and the trigeminovascular system-40 years and counting[J].Lancet Neurol,2019,18(8):795-804.
[5]Brennan KC,Pietrobon D.A systems neuroscience approach to migraine[J].Neuron,2018,97(5):1004-1021.
[6]Dodick DW.Migraine[J].Lancet,2018,391(10127):1315-1330.
[7]Li F,Qiu E,Dong Z,et al.Protection of flunarizine on cerebral mitochondria injury induced by cortical spreading depression under hypoxic conditions[J].J Headache Pain,2011,12(1):47-53.
[8]Han X,Ran Y,Su M,et al.Chronic changes in pituitary adenylate cyclase-activating polypeptide and related receptors in response to repeated chemical dural stimulation in rats[J].Mol Pain,2017,13:1744806917720361.
[9]Bernstein C,Burstein R.Sensitization of the trigeminovascular pathway:perspective and implications to migraine pathophysiology[J].J Clin Neurol,2012,8(2):89-99.
[10]Agostoni EC,Barbanti P,Calabresi P,et al.Current and emerging evidence-based treatment options in chronic migraine:a narrative review[J].J Headache Pain,2019,20(1):92.
[11]Ford JH,Jackson J,Milligan G,et al.A real-world analysis of migraine:a cross-pal study of disease burden and treatment patterns[J].Headache,2017,57(10):1532-1544.
[12]Hepp Z,Dodick DW,Varon SF,et al.Adherence to oral migraine-preventive medications among patients with chronic migraine[J].Cephalalgia,2015,35(6):478-488.
[13]Lipton RB,Stewart WF.Prevalence and impact of migraine[J].Neurol Clin,1997,15(1):1-13.
[14]Gooriah R,Ahmed F.OnabotulinumtoxinA for chronic migraine:a critical appraisal[J].Ther Clin Risk Manag,2015,11:1003-1013.
[15]Sacco S,Bendtsen L,Ashina M,et al.European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention[J].J Headache Pain,2019,20(1):6.
[16]Spindler BL,Ryan M.Medications approved for preventing migraine headaches[J].Am J Med,2020,133(6):664-667.
[17]Sandrini G,Perrotta A,Tassorelli C,et al.Botulinum toxin type-a in the prophylactic treatment of medication-overuse headache:a multicenter,double-blind,randomized,placebo-controlled,parallel group study[J].J Headache Pain,2011,12(4):427-433.
[18]Pijpers JA,Kies DA,Louter MA,et al.Acute withdrawal and botulinum toxin A in chronic migraine with medication overuse:a double-blind randomized controlled trial[J].Brain,2019,142(5):1203-1214.
[19]Silberstein SD,Blumenfeld AM,Cady RK,et al.OnabotulinumtoxinA for treatment of chronic migraine:PREEMPT 24-week pooled subgroup analysis of patients who had acute headache medication overuse at baseline[J].J Neurol Sci,2013,331(1-2):48-56.
[20]Blumenfeld A,Silberstein SD,Dodick DW,et al.Method of injection of onabotulinumtoxinA for chronic migraine:a safe,well-tolerated,and effective treatment paradigm based on the PREEMPT clinical program[J].Headache,2010,50(9):1406-1418.
[21]Labastida-Ramírez A,Caronna E,Gollion C,et al.Mode and site of action of therapies targeting CGRP signaling[J].J Headache Pain,2023,24(1):125.
[22]Tepper SJ,Diener HC,Ashina M,et al.Erenumab in chronic migraine with medication overuse:Subgroup analysis of a randomized trial[J].Neurology,2019,92(20):e2309-e2320.
[23]Silberstein SD,Cohen JM,Seminerio MJ,et al.The impact of fremanezumab on medication overuse in patients with chronic migraine:subgroup analysis of the HALO CM study[J].J Headache Pain,2020,21(1):114.
[24]Detke HC,Goadsby PJ,Wang S,et al.Galcanezumab in chronic migraine:the randomized,double-blind,placebo-controlled REGAIN study[J].Neurology,2018,91(24):e2211-e2221.
[25]Diener HC,Marmura MJ,Tepper SJ,et al.Efficacy,tolerability,and safety of eptinezumab in patients with a dual diagnosis of chronic migraine and medication-overuse headache:Subgroup analysis of PROMISE-2[J].Headache,2021,61(1):125-136.
[26]Yu S,Kim BK,Wang H,et al.A phase 3,randomised,placebo-controlled study of erenumab for the prevention of chronic migraine in patients from Asia:the DRAGON study[J].J Headache Pain,2022,23(1):146.
[27]Reuter U,Goadsby PJ,Lanteri-Minet M,et al.Efficacy and tolerability of erenumab in patients with episodic migraine in whom two-to-four previous preventive treatments were unsuccessful:a randomised,double-blind,placebo-controlled,phase 3b study[J].Lancet,2018,392(10161):2280-2287.
[28]Ferrari MD,Diener HC,Ning X,et al.Fremanezumab versus placebo for migraine prevention in patients with documented failure to up to four migraine preventive medication classes (FOCUS):a randomised,double-blind,placebo-controlled,phase 3b trial[J].Lancet,2019,394(10203):1030-1040.
[29]Mulleners WM,Kim BK,Láinez MJA,et al.Safety and efficacy of galcanezumab in patients for whom previous migraine preventive medication from two to four categories had failed (CONQUER):a multicentre,randomised,double-blind,placebo-controlled,phase 3b trial[J].Lancet Neurol,2020,19(10):814-825.
[30]Ashina M,Lanteri-Minet M,Pozo-Rosich P,et al.Safety and efficacy of eptinezumab for migraine prevention in patients with two-to-four previous preventive treatment failures (DELIVER):a multi-arm,randomised,double-blind,placebo-controlled,phase 3b trial[J].Lancet Neurol,2022,21(7):597-607.
[31]Messina R,Huessler EM,Puledda F,et al.Safety and tolerability of monoclonal antibodies targeting the CGRP pathway and gepants in migraine prevention:a systematic review and network meta-analysis[J].Cephalalgia,2023,43(3):3331024231152169.
[32]Lambru G,Hill B,Murphy M,et al.A prospective real-world analysis of erenumab in refractory chronic migraine[J].J Headache Pain,2020,21(1):61.
[33]Russo A,Silvestro M,Scotto di Clemente F,et al.Multidimensional assessment of the effects of erenumab in chronic migraine patients with previous unsuccessful preventive treatments:a comprehensive real-world experience[J].J Headache Pain,2020,21(1):69.
[34]Barbanti P,Aurilia C,Cevoli S,et al.Long-term (48 weeks) effectiveness,safety,and tolerability of erenumab in the prevention of high-frequency episodic and chronic migraine in a real world:results of the EARLY 2 study[J].Headache,2021,61(9):1351-1363.
[35]Straube A,Stude P,Gaul C,et al.Real-world evidence data on the monoclonal antibody erenumab in migraine prevention:perspectives of treating physicians in Germany[J].J Headache Pain,2021,22(1):133.
[36]Cullum CK,Do TP,Ashina M,et al.Real-world long-term efficacy and safety of erenumab in adults with chronic migraine:a 52-week,single-center,prospective,observational study[J].J Headache Pain,2022,23(1):61.
[37]Barbanti P,Egeo G,Aurilia C,et al.Fremanezumab in the prevention of high-frequency episodic and chronic migraine:a 12-week,multicenter,real-life,cohort study (the FRIEND study)[J].J Headache Pain,2022,23(1):46.
[38]Vernieri F,Altamura C,Brunelli N,et al.Galcanezumab for the prevention of high frequency episodic and chronic migraine in real life in Italy:a multicenter prospective cohort study (the GARLIT study)[J].J Headache Pain,2021,22(1):35.
[39]Bader Y,Suliman R,Harb M,et al.Effectiveness and safety of eptinezumab in episodic and chronic migraine headache in the UAE:a retrospective study[J].Neurol Ther,2023,12(5):1683-1693.
[40]Iannone LF,Fattori D,Marangoni M,et al.Switching OnabotulinumtoxinA to monoclonal anti-CGRP antibodies in drug-resistant chronic migraine[J].CNS Drugs,2023,37(2):189-202.
[41]Overeem LH,Peikert A,Hofacker MD,et al.Effect of antibody switch in non-responders to a CGRP receptor antibody treatment in migraine:a multi-center retrospective cohort study[J].Cephalalgia,2022,42(4-5):291-301.
[42]Ziegeler C,May A.Non-responders to treatment with antibodies to the CGRP-receptor may profit from a switch of antibody class[J].Headache,2020,60(2):469-470.
[43]Patier Ruiz I,Sánchez-Rubio Ferrández J,Cárcamo Fonfría A,et al.Early experiences in switching between monoclonal antibodies in patients with nonresponsive migraine in Spain:a case series[J].Eur Neurol,2022,85(2):132-135.
[44]Ghanizada H,Al-Karagholi MAM,Walker CS,et al.Amylin analog pramlintide induces migraine-like attacks in patients[J].Ann Neurol,2021,89(6):1157-1171.
[45]Schytz HW,Birk S,Wienecke T,et al.PACAP38 induces migraine-like attacks in patients with migraine without aura[J].Brain,2009,132(Pt 1):16-25.
[46]Al-Hassany L,Goadsby PJ,Danser AHJ,et al.Calcitonin gene-related peptide-targeting drugs for migraine:how pharmacology might inform treatment decisions[J].Lancet Neurol,2022,21(3):284-294.
[47]Cohen F,Armand C,Lipton RB,et al.Efficacy and tolerability of calcitonin gene-related peptide-targeted monoclonal antibody medications as add-on therapy to OnabotulinumtoxinA in patients with chronic migraine[J].Pain Med,2021,22(8):1857-1863.
作者信息
作者单位:苏州大学附属第一医院神经内科,江苏 苏州 215006
通信作者:赵红如,E-mail:tiantan11@163.com
引证本文
赵红如.A型肉毒毒素与CGRP单克隆抗体药物治疗慢性偏头痛的研究进展[J].中风与神经疾病杂志,2023,40(12):1063-1068.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#A型肉毒毒素# #慢性偏头痛# #降钙素基因相关肽# #单克隆抗体药物# #预防性治疗#
86