眼球内的“玻璃晶征”YXZX104:
2022-10-29 新乡医学影像 新乡医学影像
视乳头玻璃膜疣(Optic disc drusen,ODD)也称为透明小体或玻璃膜疣,是相对常见的病变。它们通常在CT或异常眼底镜检查的随访中偶然发现。
视乳头玻璃膜疣(Optic disc drusen,ODD)也称为透明小体或玻璃膜疣,是相对常见的病变。它们通常在CT或异常眼底镜检查的随访中偶然发现。
CT上的征象反映出玻璃膜疣含钙增多。
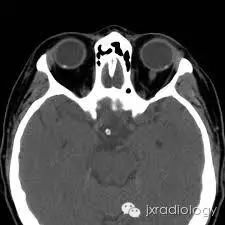
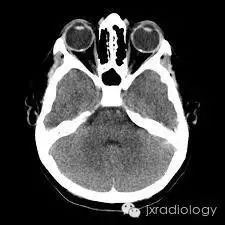
病例图片:
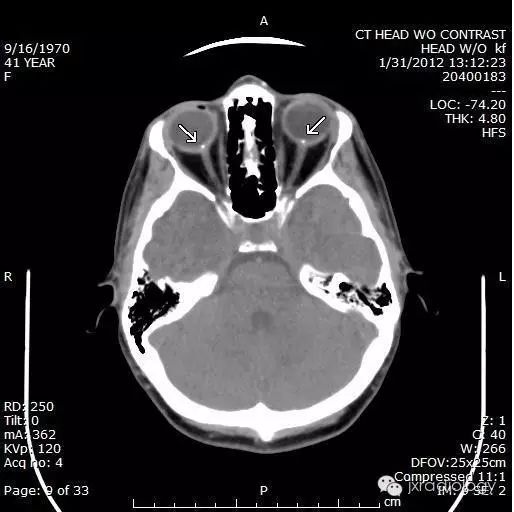
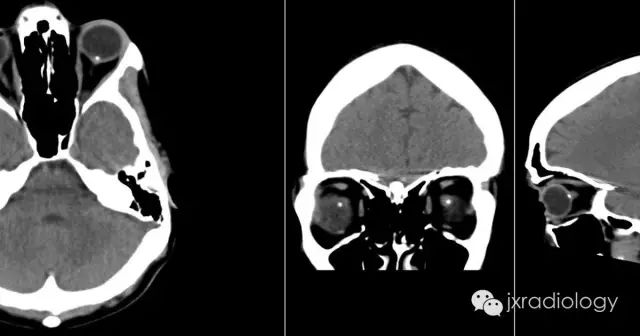
 流行病学
流行病学
视盘玻璃疣在放射检查中发现率高达0.3-3.7%,并且经常是双侧的。通常在患有年龄相关性的黄斑变性的患者中见到。它们也可以是家族性的,并且作为显性性状遗传。一般来说,他们在白种人比非裔美国人更常见。
临床表现
大多数玻璃疣的病例是无症状的,虽然患者可能报告发作性视力丧失。盲点也可以被放大,但这是轻微的。
眼底镜检查结果取决于玻璃疣位于视盘中的深度。浅表沉积物表现出特征性自发荧光,在这种情况下的诊断是显而易见。更深的沉积物具有较少特异性的外观,其具有模拟乳头状水肿(伪乳头状水肿)的视盘肿胀。
相关性
已经描述了与视神经盘玻璃疣相关联的多个实体。他们包括 :
视网膜色素变性
假黄瘤
血管样条纹症
病理
视盘玻璃疣位于筛板前的可能原因是:巩膜管狭窄→轴浆流郁滞→被筛板胶原网浓缩→钙化灶发生在筛板前→钙质进一步郁积,玻璃疣体积增大。巩膜管的纤维结构,引起轴浆流相对阻滞,这种特殊结构可以解释为什么玻璃疣不发生在其他的神经系统。
超声:眼部超声显示视神经头内部或表面有回声灶。后声阴影可表现为较大的病变。
CT:虽然在儿童时期就能被识别出来,但它们很小,而且没有矿化。因此,在儿科病人中很少发现,尽管在薄层扫描中,密度和肿胀的区域可能很明显。
扩展阅读:
玻璃膜疣(drusen)为眼底较常见的症型,其为RPE基底膜与Bruch膜之间聚集的嗜酸性染色阳性的玻璃物质,形成机理有视网膜色素上皮细胞自体崩毁学说、血源学说、转移学说、Bruch膜老化学说、沉积学说等。多为老年黄斑变性的早期体征,但临床上亦可见部分家族遗传性脉络膜变性类疾病及继发性视网膜脉络膜血管性疾病。目前详细归纳玻璃膜疣的文献较少,了解其变化原因及过程,以及其眼底影像学表现对预防和治疗相关的多种眼病具有重要意义。
1 影像学检查简介
眼底自发荧光(fundus autonflorescence,FAF)是一种无创呈现视网膜色素上皮(retinal pigmentalepithelium,RPE)及視网膜病理改变和疾病状态的成像方法。用光照激发荧光团,发出一个较长波长的光。FAF荧光的来源是内源性的,需要不同激发波长的光。目前,临床上应用较多的是用共焦扫描激光眼底镜下(confocal scanning laser ophthalmoscope,cSLO)记录的488 nm激光激发的大于500 nm的短波长自发荧光(short wavelength autofluorescence,SW-AF)和787 nm激光激发的大于800 nm的长波长的近红外自发荧光(near infrared autofluorescence,NIR-AF),前者的表现与脂褐质的分布有明显相关性。由于黄斑黄色素的遮挡和中心凹下RPE中脂褐质含量较少,黄斑中心凹AF明显减弱,最强的AF呈环形分布在黄斑边缘;后者反映的是眼底黑色素的分布,黄斑部由于RPE内黑色素较多,呈现出一个强的FAF区[1]。
眼底血管造影术包括以荧光素钠为染料,波长490 nm的蓝色可见光为激发光的荧光素眼底血管造影(fundus fluorescein angiography,FFA)及以吲哚青绿为染料,波长805 nm的近红外光为激发光的吲哚青绿血管造影(indocyanine green angiography,ICGA)。前者主要用于观察视网膜循环及视网膜屏障的异常改变,后者主要观察脉络膜血管病变。
相干光断层成像术(optical coherence tomography,OCT)利用近红外光对眼内组织结构进行断层扫描,起到类似组织病理学观察的作用,提供了一种无创、显微水平的视网膜活体观察手段。最新的OCT由于采用了傅立叶技术处理反射光信号,扫描速度可以大幅度地提高;眼球跟踪技术减少了误差干扰,使OCT像的轴向分辨率达到10 μm。
2 临床玻璃膜疣病变
2.1典型玻璃膜疣 玻璃膜疣是年龄相关性黄斑变性(AMD)典型的临床表现,其发病原因为随着年龄增长及机体内、外多种因素的影响,RPE吞噬和消化外节盘膜的功能逐渐下降,致不能消化的残余体(脂褐质)越来越多,其不断从RPE细胞底部排除而积存在Bruch膜之间,形成大量的玻璃膜疣。电子显微镜下,玻璃膜疣由许多不同的细胞产物构成,包括大小不等的嗜锇酸染色脂质颗粒,结晶样的碎屑以及由基底膜、胶原纤维等构成的颗粒[2]。玻璃膜疣形成后可引起RPE-Bruch膜-脉络膜毛细血管复合体变性,致使黄斑区和后极部视网膜脉络膜发生萎缩。其亦可引起Bruch膜内胶原层增厚,弹力纤维层断裂,使来自脉络膜毛细血管的新生血管通过裂损的Bruch膜进入RPE和视网膜神经上皮下,由于新生血管的结构不良而发生渗漏、出血,而引发一系列的病理改变[3]。玻璃膜疣又可分为硬性玻璃膜疣和软性玻璃膜疣。硬性玻璃膜疣位于眼底后极部,散在分布,可很小如点状,边界清晰,覆盖其表面的RPE常有色素脱失。玻璃膜疣也可较大,边界不清,称为软性玻璃膜疣。玻璃膜疣因含有较多脂褐素而表现为病理性高FAF[4]。眼底荧光素血管造影(FFA)下硬性玻璃膜疣及部分软性玻璃膜疣因覆盖其表面的RPE常有萎缩及色素脱失而呈现透见荧光,软性玻璃膜疣因疣体的荧光着染可呈现延迟出现的强荧光斑点[3]。玻璃膜疣的吲哚青绿血管造影(ICGA)因硬性、软性玻璃膜疣的其成分不同,造影过程中荧光表现也不尽相同。一般可呈现三种表现,且可同时存在同一患眼:①由于疣体对脉络膜的遮蔽作用,造影过程中一直为边界清晰的弱荧光;②因疣体本身的荧光着染,随造影时间延长,疣体荧光度增强,数量增多;③玻璃膜疣的自发荧光,造影过程中疣体荧光亮度保持不变[5]。光学相干断层成像术(OCT)观察萎缩型老年黄斑变性患者的玻璃膜疣,发现玻璃膜疣的形状可为圆顶形、尖形、锯齿形和扁平形,疣体内部可表现为强反射、中反射和弱反射,并观察到可有其表面的RPE和光感受器的缺失。其中最常见的玻璃膜疣为圆顶形,内部反射为中等均质信号,多不伴有光感受器和其内、外节的损害[5]。2.2基底膜层状玻璃膜疣(basal laminar drusen,BLD) 常见于40~60岁人群,通常为双眼发病,与典型玻璃膜疣在临床表现、病理生理变化、预后转归等方面均不完全相同。电子显微镜下其病理组织学的改变为RPE底部细胞内褶与色素上皮基底膜之间有长条形胶原沉着,RPE基底膜也可以有结节状增厚[3]。其可随年龄增长而逐渐增多,其与AMD关系不大。眼底镜下见患眼颞上下血管弓以内可见数量不一、黄白色、圆形的点状病灶,呈散在或聚集成簇状分布。FFA检查显示患眼后极部疣状物所在区域动脉期均可见到大小不一、单个或融合成簇状的点状强荧光。在暗背景对比下可见典型“星空状”表现。造影晚期点状强荧光的荧光强度均减弱。未见荧光渗漏和形态大小变化。FFA造影中“星空样”这一特征性的表现被认为是BLD的主要确诊依据[6]。OCT检查显示患眼RPE-Bruch膜复合体层丧失光滑完整的结构,可见多个连续、呈锯齿状的小结节状突起,部分患者黄斑中心凹光感受器内、外节层与RPE层分离,视网膜神经上皮层局部隆起[7]。卵黄样黄斑脱离是BLD的另一特征性眼底表现,在OCT像上显示为嵌合体带层与RPE层分离。这种分离产生的腔隙被称为“卵黄样腔隙”,在腔隙的底部,可见与BLD相对应的RPE层锯齿状突起[8]这种卵黄样腔隙可诱发浆液性或出血性RPE脱离,并刺激脉络膜新生血管形成。
2.3网状假性玻璃膜疣(reticular pseudodrusen,RPD) 目前,关于RPD的发病机制尚不明确。其发病过程可能是单一因素诱导一系列病理过程,亦可能是多种因素交叉反应的结果。视网膜色素上皮(RPE)病变、慢性炎症反应、光感受器细胞受损、脉络膜病变等因素都被认为有可能是RPD发病因素。组织病理研究发现RPD出现中间脉络膜小血管缺失及脉络膜上腔静脉间距增大,由此推测RPD的形成可能与脉络膜的血管缺失及其基质的纤维化有关[9]。有学者研究认为RPD是视网膜下的疣样物质沉积,并证实沉积物主要成分与玻璃膜疣的成分类似,为各种细胞膜碎片、未酯化的胆固醇及补体因子等,而这些细胞膜碎片又以光感受器细胞的外节碎片为主要成分[10]。RPD的发展相对独立,多发生在黄斑区上方,常常由下向上发展;有时也可能向其他象限发展,可達视盘的边缘。最初RPD多出现于黄斑中心凹上方及颞上血管弓之间,常不累及中心凹,眼底表现为网状交织样淡黄色病灶。随着眼底病变的进展,逐渐累及网状间隙间的正常组织,形成黄色病变区域,甚至出现灰白色病变。在眼底自发荧光检查中表现为弱荧光,因RPD患者的RPE内侧出现异常物质沉积,阻断了来自RPE的反射,可以解释RPD弱自发荧光的形成。Sarks等[11]认为眼底AF检查是鉴别RPD最可靠的检查手段,其鉴别敏感性可大于90%。与蓝光眼底成像相比,NIR-AF在RPD的鉴别上具有更高的敏感性。在NIR-AF中,RPD多表现为暗的低反射病灶。在FFA影像上,RPD表现为一种弱的增强荧光网状图像。放大图像发现,在RPD的周围环绕着一圈弱增强荧光光环。但是,FFA的这种表现并不具有特异性,所以FFA影像只能为RPD的诊断提供补充信息。而ICGA中晚期的网状弱荧光是RPD特征性表现[12],这与前述的RPD出现中间脉络膜小血管缺失及脉络膜上腔静脉间距增大相吻合。频域OCT在RPD的诊断上具有较高的敏感性和特异性。RPD的频域OCT图像表现为高反射物质在RPE上沉积,同时IS/OS层波浪状隆起。尽管NIR-AF和频域OCT在RPD的诊断上具有较高的敏感性和特异性,但仍应该通过联合应用多种检查方式来达到提高RPD诊断率的目的[13]。
2.4家族性显性玻璃膜疣(malattia leventinese/doyne honeycomb retinal dystrophy,ML/DHRD) 家族性显性玻璃膜疣是一种罕见的常染色体显性黄斑退行性疾病。1999年,美国眼科医生Stone[14]等将这种疾病的基因确定为EFEMP1。该基因突变改变了细胞外基质蛋白的代谢,导致黄斑区Bruch膜附近区域的病变[15]。其典型的眼底特点为黄斑区视网膜色素上皮层和Bruch膜之间大量的放射状玻璃膜疣。在初期,玻璃膜疣呈散在分布,形态表现较小,而随着病变的加重,其影像表现逐渐变大,最终覆盖整个Bruch膜和RPE层。晚期时表现为黄斑部视网膜下瘢痕、地图样萎缩、色素改变、脉络膜新生血管。FFA检查显示,在早期黄斑区、视盘周围的玻璃膜疣影像学表现为强荧光,晚期强荧光则逐渐融合并减弱。OCT检查提示RPE-Bruch膜增厚,形成多个局部圆顶状的小隆起[16]。研究[17]报道一家系为显性玻璃膜疣合并高度远视,提示临床上应注意家族性玻璃膜疣和高度远视存在基因连锁的可能性。
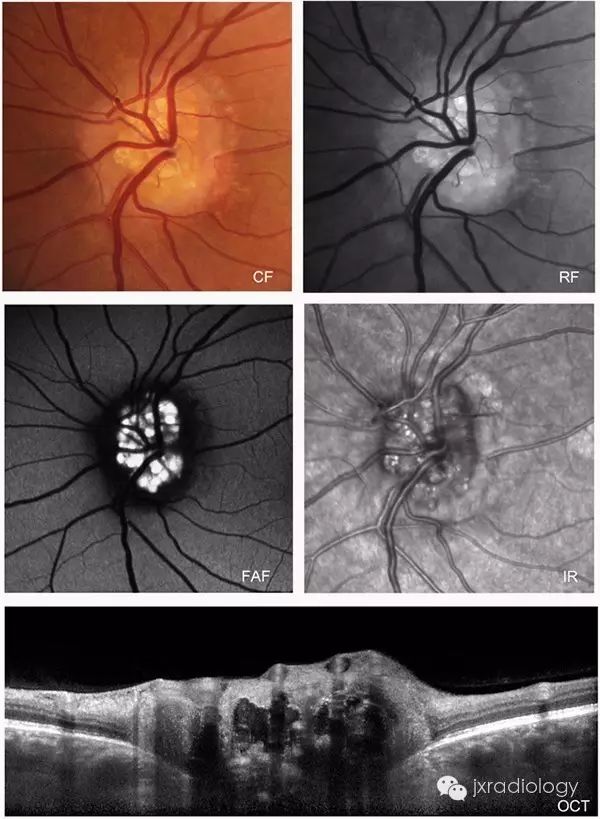
2.5视盘玻璃膜疣 视盘玻璃膜疣(optic disc drusen,ODD)是一种与视网膜玻璃膜疣名称相同而病理改变及发病机制迥异的疾病,其可分为原发性和继发性两种,后者继发于炎症和外伤。在此所述为与先天有关的原发性视盘玻璃膜疣。其发病机制有研究认为可能是基因突变引起;另有研究认为是因视神经纤维轴浆崩解、钙化或先天性的血管异常造成的血浆蛋白传输障碍郁积在视盘引起。电子显微镜下见玻璃膜疣多位于视盘筛板前区、视盘内有大小不一、呈环板状排列的无细胞结构的嗜碱性小体[2]。根据玻璃膜疣病变位置的深浅有可分为埋藏性玻璃膜疣和表面性玻璃膜疣。表面性玻璃膜疣眼底检查可见视盘结节状胶样隆起,并可融合为不规则的较大团块向玻璃体内突出如桑葚状,较易诊断。埋藏性ODD的眼底影像学表现显示视乳头轻度隆起,边界欠清晰,有时显示假性视乳头水肿。因疣体压迫、损伤视乳头上或周围毛细血管,可引起视盘或其周围视网膜出血。自发荧光表现为视盘自发荧光。FFA对诊断埋藏性玻璃膜疣具有极其重要的价值,造影早期视盘局部荧光素明显增强,造影后期玻璃膜疣处荧光素染色明显,但无荧光素渗漏。OCT检查可见患眼视盘视网膜神经纤维层(RNFL)高度隆起,其下方可见团块状高反射信号。B超是诊断ODD最有效的方法,因疣内存在钙质,检测结果会显示有强回声光团存在于视盘强方,其周边显示呈暗区,降低增益,光团不消失。有研究[18]发现对埋藏性视盘玻璃膜疣使用B超联合OCT检查,是非常可靠的诊断方法,两者联合应用,可有效提高检出率。有学者[19]认为,将玻璃膜与视网膜色素上皮层之间的drusen定义为玻璃膜疣,而将发生在视盘的drusen定义为视盘玻璃疣,这样可以更加明确drusen的概念。3 总结
目前,现代眼底影像学检测由单项检查转变为多项检查。各种眼底影像学检查反映的多为眼底平面影像,OCT则为眼底组织光学断层扫描,两者相结合,可以形成三维立体的影像学检查,而FFA及ICGA则考虑了时间的因素,这几种检查方法相结合,共同构成了眼底影像检查的四维水平。几种方法发挥自身特点的同时,又相互弥补了各自的不足之处。通过眼底不同部位、不同层次的玻璃体疣的多种影像学表现,可是我们更好的理解病变的发病机制、组织学改变,进而更好的掌握疾病的诊断、治疗方法。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言