Lancet Haematol:Ponatinib和贝林妥欧单抗使Ph+ ALL深度缓解,是否无需移植?
2022-11-26 聊聊血液 聊聊血液 发表于安徽省
本研究的深度分子学缓解和初步的无病随访表明,Ponatinib联合贝林妥欧单抗的毒性较低,并可能无需HSCT而治愈Ph+成人ALL患者。
Ph+ ALL
对于新诊断的费城染色体阳性(Ph+)成人急性淋巴细胞白血病(ALL)患者,多采用强化化疗加TKI治疗,然后在首次缓解后进行异基因造血干细胞移植 (HSCT)。在常规化疗基础上加用TKI可显著改善治疗结局,但治疗相关耐药和毒副反应导致远期疗效不理想。
近十年来患者结局和毒性均有所改善,其中包括三代TKI ponatinib纳入一线使用,它对 ABL1 酪氨酸激酶结构域中的守门员突变 Thr315Ile 有活性,可规避最一代和二代TKI常见的耐药机制,从而改善患者结局,3年总生存率为83%,完全分子学缓解率更高。而达到完全分子学缓解(定义为10000个单核骨髓细胞中白血病原始细胞<1个),对于未接受异基因体造血干细胞移植 (HSCT) 的 Ph+ ALL患者来说,与总生存期改善密切相关。
贝林妥欧单抗是CD3–CD19双特异性 T 细胞衔接系统,其联合达沙替尼作为新诊断Ph+成人ALL患者达沙替尼联合糖皮质激素诱导治疗后的巩固治疗方案,将完全分子学缓解的患者比例从诱导后的29%增加至2个周期贝林妥欧单抗后的60%,38%的患者接受了HSCT,4年OS可达78%,证实了TKI联合贝林妥欧单抗这一无化疗方案的可行性。
高达75%的复发患者中检测到ABL1 944C→T(Thr315Ile),一代或二代 TKI 中该突变是 Ph+ ALL治疗耐药的主要机制,而Ponatinib是一种强效泛BCR–ABL1 TKI,在ABL1 944C→T(Thr315Ile) 时仍具有活性。
鉴于Ponatinib和贝林妥欧单抗在 Ph+ ALL患者中的明确疗效,以及许多使用一代或二代BCR–ABL1 TKI治疗的患者复发伴ABL1 944C→T(Thr315Ile),MD安德森癌症中心Elias Jabbour教授等提出假设,即Ponatinib联合贝林妥欧单抗的无化疗联合治疗将产生深度且持久的缓解,有可能克服患者对异基因HSCT 的需求。并在Ph+ ALL(包括新诊断和复发/难治)和急变期慢性髓系白血病患者中展了一项2期研究,近日发表于《Lancet Haematology》。

研究设计
该研究是在MD 安德森癌症中心开展的单中心2期研究,旨在评估Ponatinib联合贝林妥欧单抗治疗Ph 阳性急性淋巴细胞白血病或急变期慢性髓系白血病(CML)患者的疗效和安全性。
主要入组条件:纳入年龄≥18岁;确诊为新诊断 Ph 阳性急性淋巴细胞白血病、复发或难治性 Ph 阳性急性淋巴细胞白血病或处于急变期的慢性髓性白血病的患者,接受过1个或2个疗程化疗(不考虑BCR–ABL1 TKI使用情况)的患者可入组新诊断队列;ECOG 体能状态评分≤2;总胆红素≤2×ULN或≤2.4 mg/dL,ALT和AST≤3×ULN,血清脂肪酶和淀粉酶≤3×ULN。排除未控制的心血管疾病或临床显著 CNS 异常的患者,但CNS 白血病(脑脊液中白血病原始细胞细胞学检查阳性)患者可入组。
每6周一个周期,最多5周期。贝林妥欧单抗在第1周期第1-4天给药9 μg/天,随后第5-28天增加至28 μg/天,后为2周无治疗间期;第2-5周期给药剂量为28 μg/天,持续4周,之后是2周停药期。Ponatinib在第1周期每日口服30 mg,一旦完全分子学缓解则将帕纳替尼减至每日15 mg。完成贝林妥欧单抗治疗后Ponatinib应作为维持治疗至少继续使用5年。此外交替给予鞘内甲氨蝶呤 12 mg 和阿糖胞苷 100 mg 作为 CNS 预防,每周期给药3次,共给药12次;入组时 CNS 受累的患者根据标准治疗接受 CNS 鞘内化疗;推荐预防性抗菌药、每天 75-100 mg 阿司匹林和一种他汀类药物。
新诊断Ph+ ALL患者的主要终点是完全分子学缓解(定义为 PCR 未检测到BCR–ABL1转录本,灵敏度0.01%),复发/难治性患者或急变期CML患者的主要终点为总体缓解(定义为完全缓解和完全缓解伴不完全血液学恢复);次要终点包括安全性、无事件生存期和总生存期。
研究结果
患者
共入组入组60例患者,包括40例(67%;中位年龄57岁)新诊断 Ph+ ALL患者,14例(23%;中位年龄38岁)复发/难治性Ph+ ALL患者,6例(10%;中位年龄69岁)急变期CML。32例 (53%) 患者为男性,28例 (47%) 为女性;51例 (85%) 患者为白人或西班牙裔(表1)。40例新诊断Ph+ ALL患者中有30例 (75%) 携带 P190 融合蛋白。三个队列中CD19表达中位数为99.8%。

疗效
新诊断 Ph+ ALL队列:40例中的12例 (30%) 在入组时为完全缓解。28例可评估患者中的26例 (93%) 达到完全缓解,1例 (4%) 达到完全缓解伴血液学不完全恢复(表2)。32例可评估患者中有30例 (94%) 在第1周期后通过流式细胞术检测到 MRD 阴性,所有32例 (100%) 可评估患者均在第2周期后达到MRD 阴性。治疗1个周期后,38例可评估患者中的26例 (68%) 达到完全分子学缓解,33例 (87%)在治疗过程中的任何时间达到完全分子学缓解。总体而言,在新诊断Ph+ ALL队列的25例检测患者中,22例 (88%)达到MRD 阴性(NGS;1 × 10-6);22例患者中的3例 (14%) 在3、6和29个月时通过 PCR 可检测到BCR–ABL1。
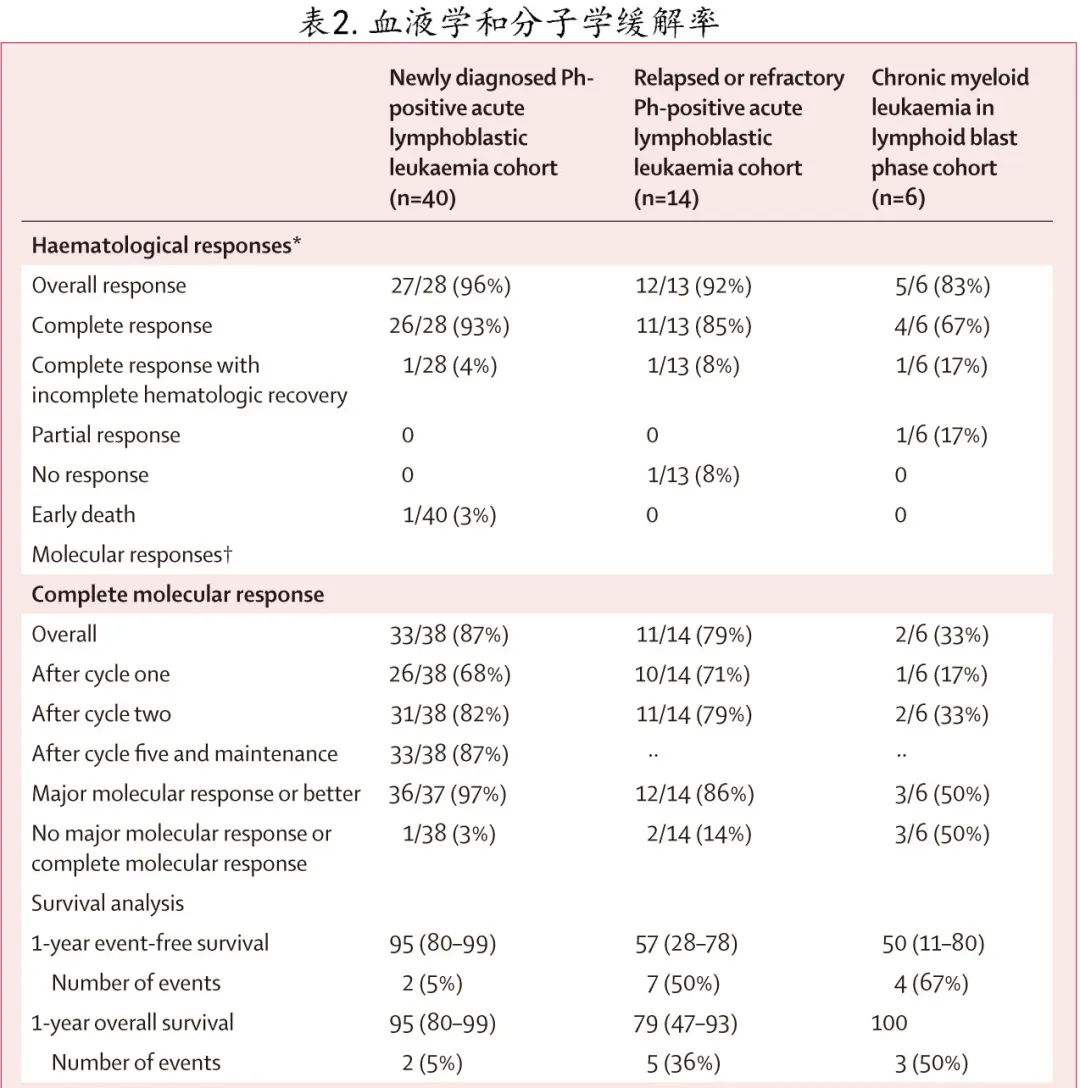
复发/难治性 Ph + ALL队列:1例患者在入组时达到完全血液学缓解,14例中的13例 (93%) 可评估血液学缓解。11/13例达到 (85%) 完全缓解,1例 (8%) 达到完全缓解伴血液学不完全恢复;所有血液学缓解均发生在一个周期后。14例患者中的12例 (86%) 在第1周期后和13例 (93%) 在2个周期后达到MRD 阴性(流式)。10例 (71%) 患者在第1个周期后和11例 (79%) 患者在5个周期后达到完全分子学缓解。
急变期CML队列: 2例入组时存在 CNS 受累。6例患者中5例 (83%) 达到完全缓解或完全缓解伴血液学不完全恢复,1例 (17%) 患者最佳缓解为部分缓解。6例患者中的4例 (67%) 在第1周期后通过流式证实 MRD 阴性,5例患者 (83%) 在研究任何时间达到 MRD 阴性。完全缓解或完全缓解血液学不完全恢复的5例患者中有1例 (20%) 在第1周期也达到完全分子学缓解。6例患者中仅有2例 (33%) 的最佳总体缓解为完全分子学缓解。
研究概况及移植
新诊断 Ph+ ALL队列:接受的中位周期数为5,38例 (97%) 患者持续血液学缓解;仅1例患者在首次缓解时接受了异基因HSCT,该患者因持续可检测到BCR–ABL1转录水平0.01–0.05%而接受移植。37例未接受异基因 HSCT 患者的中位缓解持续时间为15个月。40例患者中的6例 (15%) 中止了方案治疗(图1)。
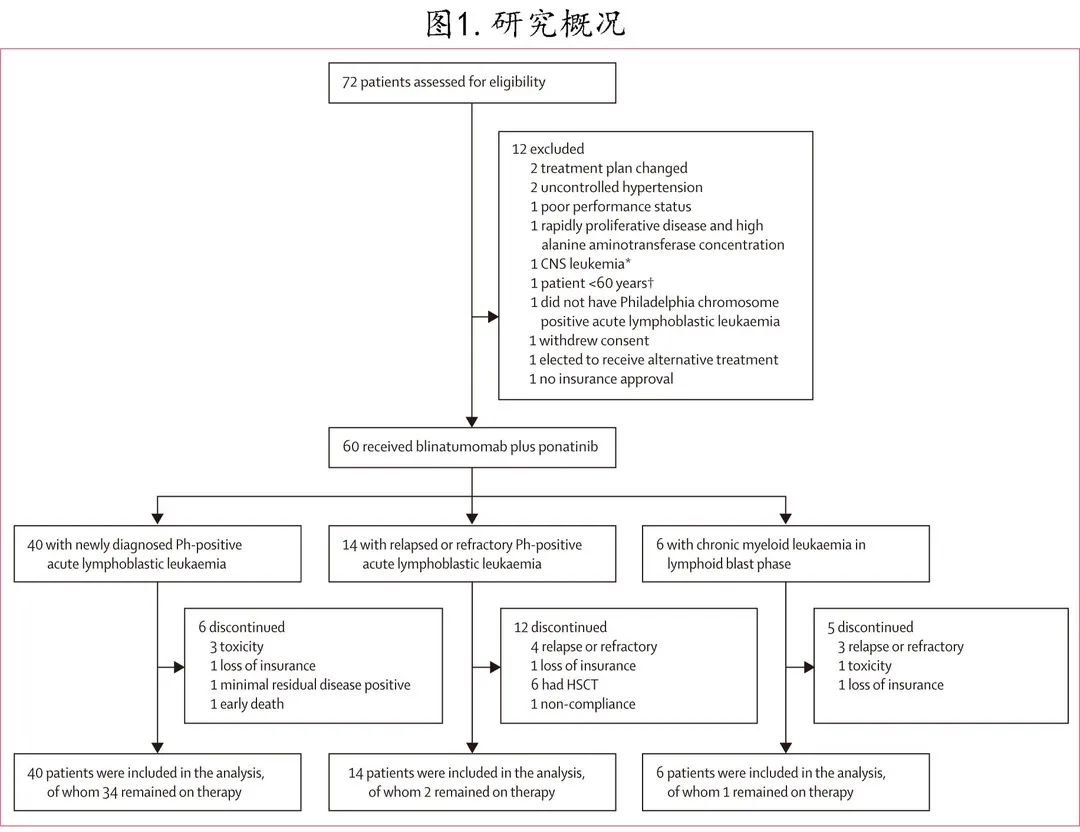
复发/难治性 Ph + ALL队列:接受的中位周期数为3。缓解的13例患者中的6例 (46%) 进行了异基因HSCT(1例随后复发;5例仍存活),4例 (31%) 患者未移植但随后复发,1例在完全缓解时死亡,2例患者在未移植的情况下持续缓解。10例 (71%) 患者没有完成5个周期的治疗。
急变期CML队列:接受的中位周期数为3。6例患者中的3例 (50%) 随后复发,其中1例患者的免疫表型转变为 CD19 表达缺失的髓系急变期CML;另外2例患者在未接受异基因HSCT 的情况下持续缓解。5名例(83%) 患者没有完成5个周期的治疗。
次要终点
整个队列的中位随访持续时间为16个月,其中新诊断Ph+ ALL队列为15个月,复发/难治性 Ph+ ALL队列为22个月,急变期CML队列为25个月。
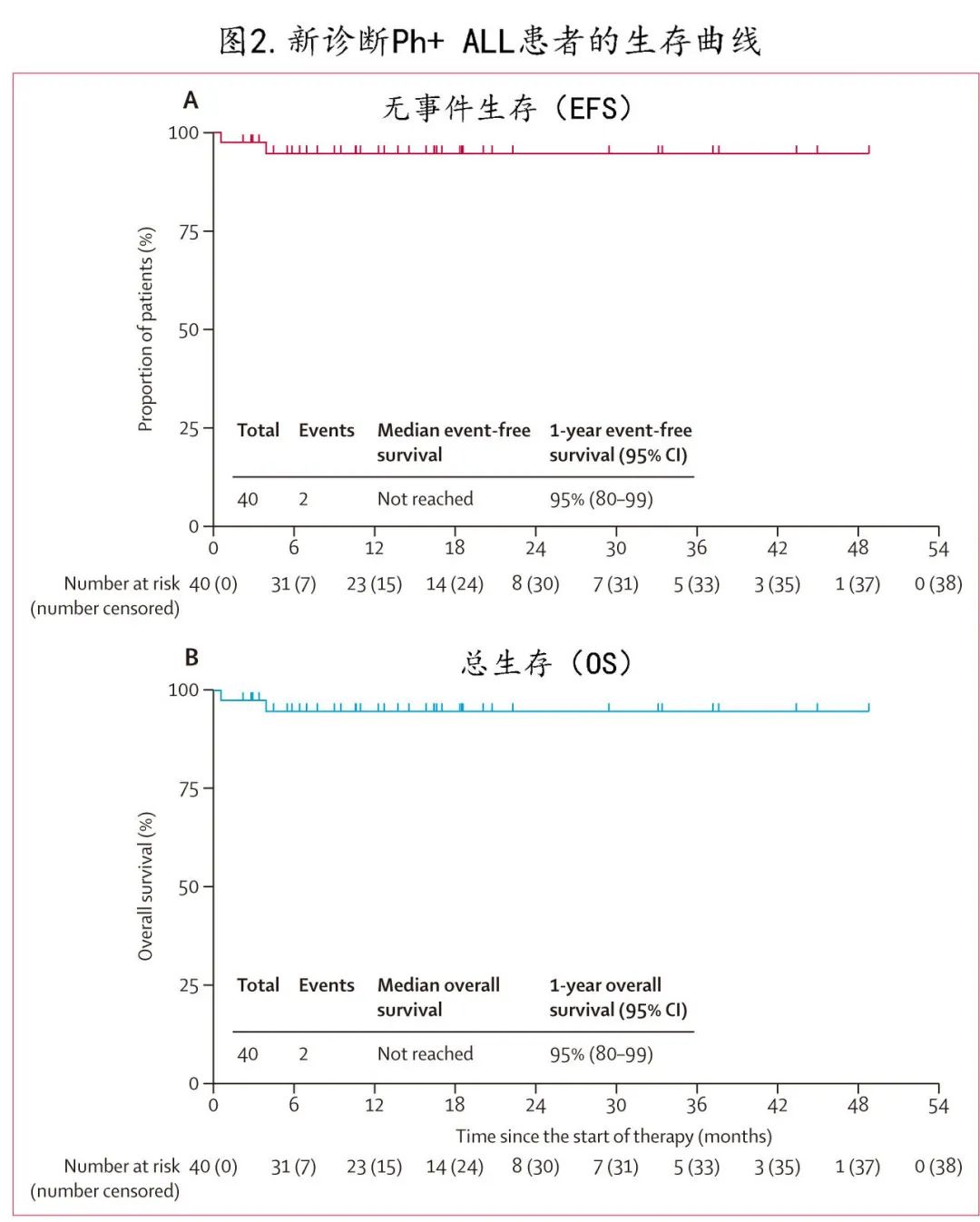
新诊断Ph+ ALL队列:估计的1年无事件生存率为95%(图2A),总生存率为95%(图2B),该队列中未观察到复发和白血病相关死亡。在事后分析中,入组时完全缓解的患者与入组时有活动性疾病的患者之间未观察到1年无事件生存率(完全缓解患者为100%,活动性疾病患者为92%;p= 0.33)和1年总生存率(100% vs 92%;p= 0.33)的差异。
复发/难治性Ph+ ALL队列:估计的1年无事件生存率为57%,总生存率为79%。13例患者中的5例 (38%) 持续缓解超过12个月(4例接受了异基因HSCT,1例未移植),4例(29%的患者死于进行性白血病,1例 (7%) 患者在失访后死于未知原因。
急变期CML队列:估计的1年无事件生存率为50,总生存率为100%。
安全性
未发生4-5级药物相关不良事件(表3)。≥5%的最常见严重不良事件为感染和发热性中性粒细胞减少 (22/60 [37%])、脂肪酶和淀粉酶浓度升高 (5/60 [8%])、ALT或AST升高 (4/60 [7%])、高血压 (4/60 [7%])、疼痛 (4/60 [7%]) 和高血糖 (3/60 [5%])。事后分析发现,181起不良事件中有115起 (64%) 发生在第1周期,55起 (30%) 发生在第2-5周期,11起 (6%) 发生在Ponatinib单药维持治疗期间。60名患者中有5名 (8%) 因不良事件而减少了研究药物的剂量。
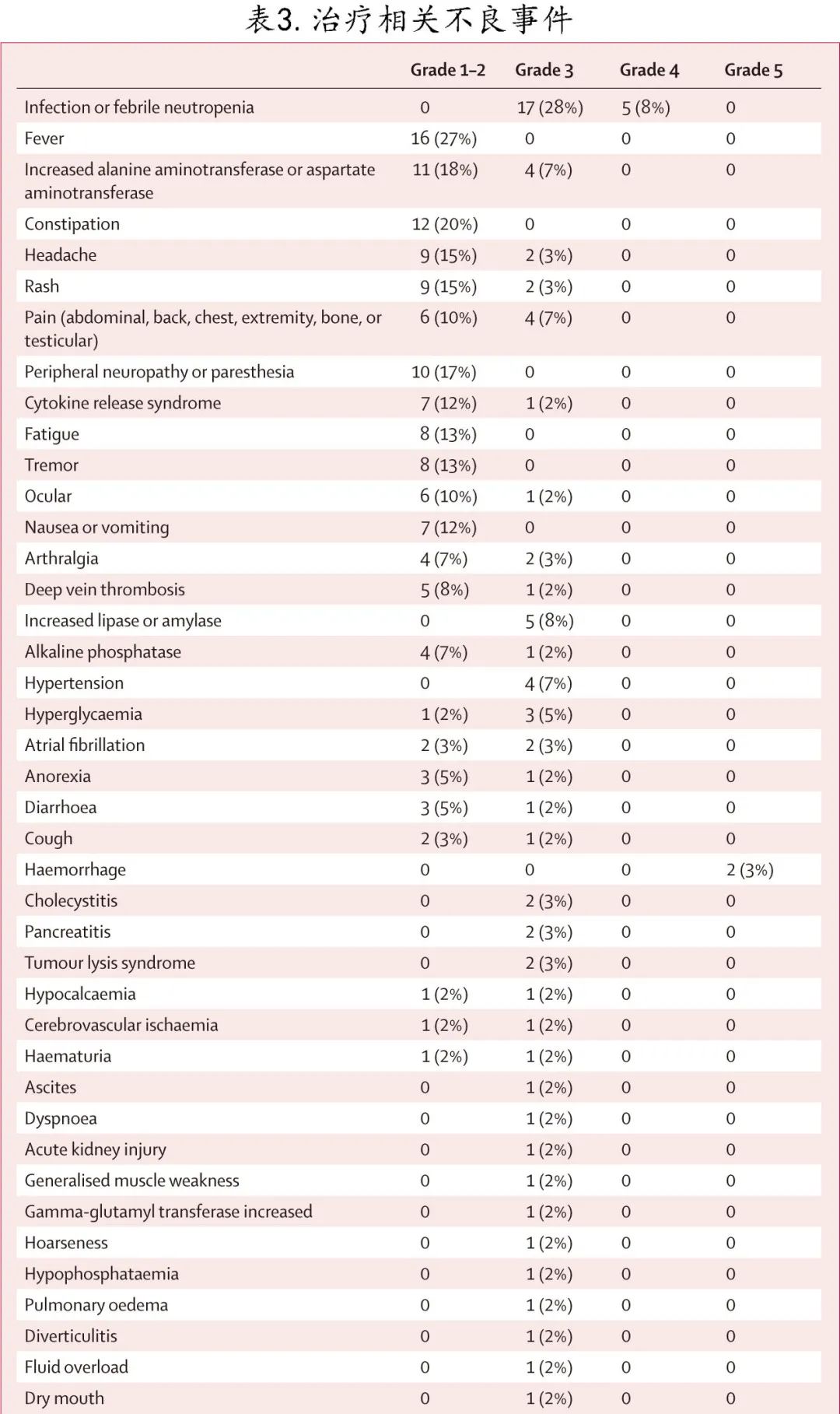
3例 (5%) 患者因相关不良事件而停用Ponatinib,1例 (2%) 患者因相关不良事件而停用贝林妥欧单抗。在一项事后分析中,17例年龄≥60岁的患者中有3例 (18%) 因治疗相关不良事件而停用一种研究药物,而年龄<60岁的患者中无一因治疗相关不良事件而停药。此外未观察到给药相关死亡。
讨论
该研究有多个创新:除鞘内化疗外,治疗方案无化疗;既往研究为贝林妥欧单抗和 TKI 序贯给药,而本研究是在相同的治疗周期中联合给药;研究纳入所有年龄的成人,包括 CNS 病变患者,而这些患者经常被其他贝林妥欧单抗研究所排除2。
本研究发现,对于 Ph+ ALL或急变期CML患者,Ponatinib联合贝林妥欧单抗的无化疗联合方案安全有效。在新诊断Ph+ ALL患者中完全分子学缓解率为87%,1年总生存率为95%,未观察到复发;尽管该队列中仅1例患者接受了异基因 HSCT 巩固治疗,但仍观察到了这一令人鼓舞的结果。异基因移植率极低 (2.5%),这与大多数其他Ph+ ALL的前瞻性研究(相当大比例的患者在首次缓解时接受了异基因 HSCT )形成对比,也许在首次缓解时无需常规进行异基因HSCT。
值得注意的是,该联合方案不存在与常规细胞毒化疗相关的毒性,未报告与治疗相关的4-5级不良事件,但部分患者因低级别不良事件导致研究药物剂量减少或停药。联合方案治疗新诊断Ph+ ALL患者的中位周期数是5,而复发/难治性 Ph+ ALL和急变期CML患者为3。
综上所述,本研究的深度分子学缓解和初步的无病随访表明,Ponatinib联合贝林妥欧单抗的毒性较低,并可能无需HSCT而治愈Ph+成人ALL患者。
此外复发/难治性Ph+ ALL和急变期CML患者的完全分子学缓解率较低(分别为11/14 [79%]和2/6[33%])。
参考文献
1. Elias Jabbour, Nicholas J Short, Nitin Jain,et al.Ponatinib and blinatumomab for Philadelphia chromosomepositive acute lymphoblastic leukaemia: a US, single-centre, single-arm, phase 2 trial.Lancet Haematol . 2022 Nov 16;S2352-3026(22)00319-2. doi: 10.1016/S2352-3026(22)00319-2.
2. Judith M Boer, Inge M van der Sluis.Towards chemotherapy-free treatment of Philadelphia chromosome-positive acute lymphoblastic leukaemia. Lancet Haematol . 2022 Nov 16;S2352-3026(22)00351-9. doi: 10.1016/S2352-3026(22)00351-9.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言