CSCO 2021:肝胆肿瘤一线优化治疗布局思考
2021-09-29 MedSci原创 MedSci原创
晚期肝胆肿瘤的治疗进展突飞猛进,多项重磅临床研究结果发布!
近年来,晚期肝胆肿瘤的治疗进展突飞猛进,多项重磅临床研究结果发布,包括免疫治疗、靶向治疗及化疗的单药治疗和联合治疗,延长了患者的生存期以及提升了患者生存质量。
9月27日,在全国临床肿瘤学大会(CSCO)学术年会上,来自北京协和医院肝脏外科主任医师赵海涛教授对肝胆肿瘤研究进展进行了总结,分享了题为“肝胆肿瘤一线优化治疗布局思考”精彩报告。
截止到目前为止,我国有5款一线治疗药物/方案用于晚期肝细胞肝癌(HCC),包括FOLFOX4、仑伐替尼、阿替利珠单抗+贝伐珠单抗、多纳非尼、信迪利单抗+IBI305。
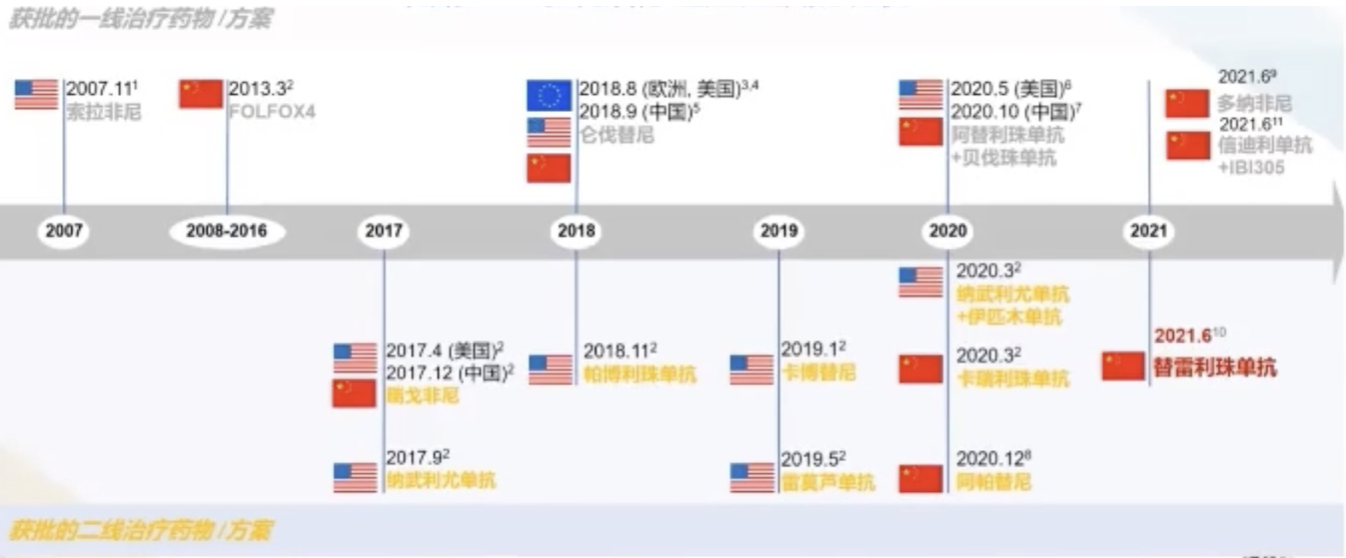
晚期HCC系统治疗适应症获批发展历程.
在以往靶向/免疫单药研究结果显示,ORR约为3.3~18.8%,其中仑伐替尼和纳武利尤单抗较高,PFS约为2.8~7.4个月,其中仑伐替尼较高。在联合治疗方面,ORR约为20.5%~36%,PFS约为4.6~8.6个月,OS预计接近2年。
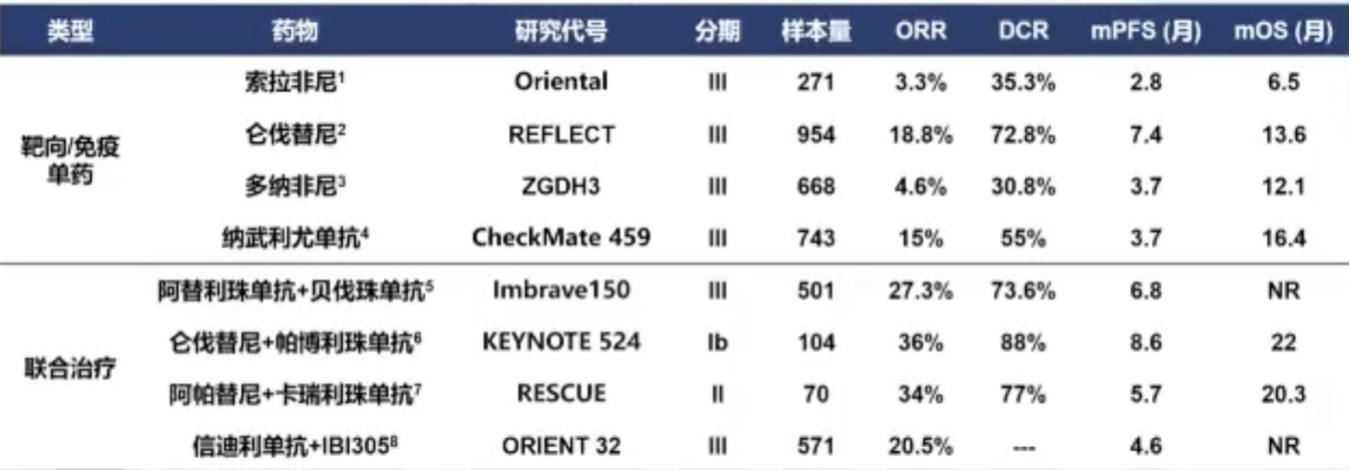
HCC一线治疗既往研究结果.
一线单药治疗研究:仑伐替尼REFLECT研究
REFLECT研究是一项全球、随机、开放标签、III期临床研究,评估仑伐替尼(Lenvatinib)对比索拉非尼(sorafenib)一线治疗不可切除肝细胞癌(uHCC)患者的疗效。
结果表明,仑伐替尼非劣效于索拉非尼。在全球数据中,仑伐替尼的中位OS为13.6 个月 (95% CI, 12.1–14.9),索拉非尼为12.3个月(95%CI,10.4–13.9)。另外,在中华区人群中,仑伐替尼显著改善OS,中位总生存期延长4.8个月。
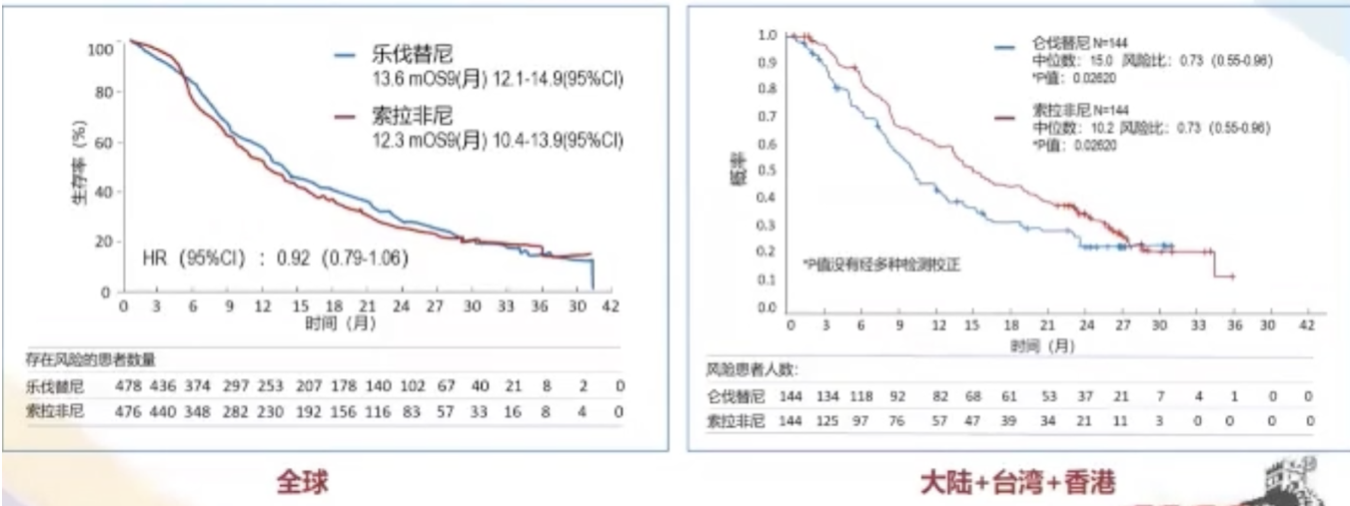
次要终点显示,与索拉非尼相比,仑伐替尼明显延长PFS为7.4 个月,而在中华区人群更加的显著。在安全性方面,仑伐替尼严重不良反应发生率较高。仑伐替尼最常见的不良反应为高血压,而索拉非尼最常见的不良反应为手足综合征。
一线单药治疗研究:多纳非尼ZGDH3研究
ZGDH3是一项开放标签、随机、平行对照、多中心的关键性II/III期临床试验,评估多纳非尼对索拉非尼一线治疗无法切除或转移性HCC患者的疗效和安全性。
该研究在中国37家研究中心开展,共收纳668例不可手术或转移性肝细胞癌患者,并以1:1的比例随机入组多纳非尼治疗组或索拉非尼治疗组。研究主要终点为总生存期(OS),次要终点包括无进展生存时间、客观缓解率、疾病控制率、安全性等。
结果表明,多纳非尼族组的中位OS显著长于索拉非尼(FAS:12.1个月与10.3个月;风险比为0.831)。多纳非尼组和索拉非尼组的ORR分别为4.6%和2.7%(P=0.2448),DCR分别为30.8%和28.7%(P=0.5532)。第24周时,多纳非尼组(20.7%)的患者获得疾病控制的比例高于索拉非尼(15.7%)。随后的分析证实,第24周的DCR对长期生存率有显著影响(P<0.0001)。

一线联合治疗研究:“阿替利珠单抗+贝伐珠单抗”奠定新基石
IMbrave150是一项全球、多中心、开放标签、随机、Ⅲ期研究,是全球首个获得成功的肝癌免疫联合治疗疗法。阿替利珠单抗+贝伐珠单抗已成为被NCCN、CSCO、ESMO等多个权威指南推荐的肝细胞癌一线治疗方案。
在这项研究中,共纳入501例不可切除HCC初治患者,按2:1比例随机接受阿替利珠单抗+贝伐珠单抗或索拉非尼一线治疗,比较评估阿替利珠单抗+贝伐珠单抗和索拉非尼在不可切除肝癌患者中的疗效。研究主要终点为OS和PFS。
结果显示,在总体人群中阿替利珠单抗+贝伐珠单抗较索拉非尼组显著延长OS(未达到 vs. 13.2个月; HR =0.58,95%CI:0.42~0.79)和PFS(6.8个月 vs 4.3个月; HR =0.59,95%CI:0.47~0.76),同时阿替利珠单抗+贝伐珠单抗组的客观缓解率更高(27% vs. 12%, P <0.0001)。
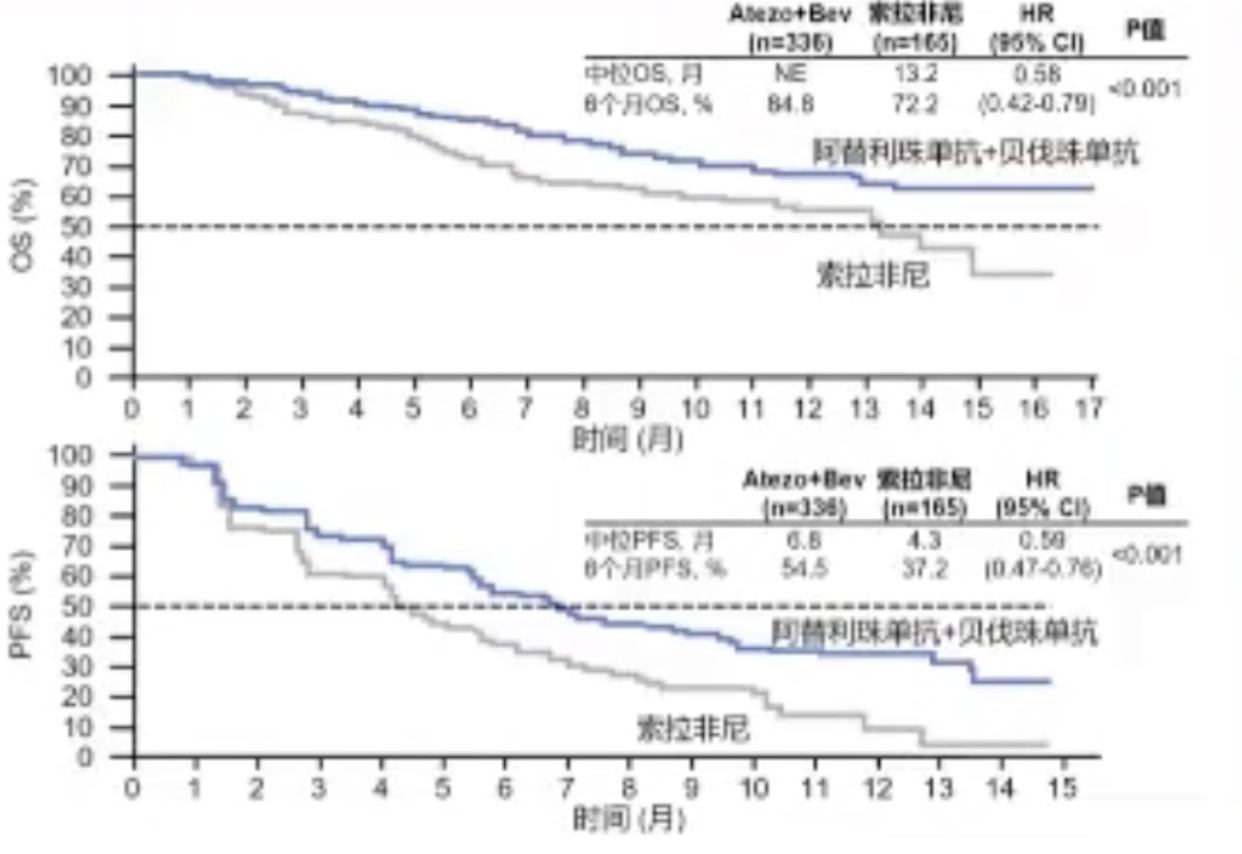
研究还显示,阿替利珠单抗+贝伐珠单抗使患者报告生活质量恶化时间明显延迟,较索拉非尼延迟7.6个月。总体人群阿替利珠单抗+贝伐珠单抗≥3级以上的不良反应两治疗组大致相当,联合组36%,索拉非尼单药组46%。更重要的是,接受阿替利珠单抗+贝伐珠单抗治疗的中国亚群OS与PFS也均取得显著改善。
一线联合治疗研究:帕博利珠单抗+仑伐替尼KEYNOTE 524 Ib期研究
KEYNOTE 524是一项多中心,开放标签,Ib期研究,共纳入104例不可切除HCC患者,接受帕博利珠单抗+仑伐替尼的疗效。研究主要终点为独立审查委员会(IIR)根据mRECIST 和RECIST v1.1 评估的客观反映率ORR和持续反应时间DOR;次要终点为研究者根据mRECIST评估的ORR和DOR,以及PFS、TTP、TTR和OS。
结果显示,IIR确认的ORR为46%(mRECIST)和36%(RECIST v 1:1),中位DOR为8.6个月(mRECIST)和12.6个月(RECIST v 1:1),中位PFS为9.3个月(mRECIST)和8.6个月(RECIST v 1:1),中位OS为22个月。

帕博利珠单抗+仑伐替尼获得FDA突破性疗法认证和2020 CSCO指南III级推荐(2B类证据)。然而,由于缺少对照,该治疗方案究竟能带来多大的生存获益还有待于Ⅲ期研究的证实,目前正在进行中。
一线联合治疗:卡瑞利珠单抗+阿帕替尼RESCUE研究
RESCUE是一项非随机、开放标签、多中心、2期研究,纳入190例晚期HCC患者,其中70例为初治患者(一线队列),120例为一线靶向治疗难治或不耐受的经治患者(二线队列),所有患者接受卡瑞利珠单抗+阿帕替尼,主要终点为ORR。
结果显示,一线队列达到主要终点,中位OS为20.3个月,ORR达34%,DCR为77%,中位PFS为5.7个月。2020年CSCO指南III级推荐,卡瑞利珠单抗+阿帕替尼用于一线治疗(2B类证据)。
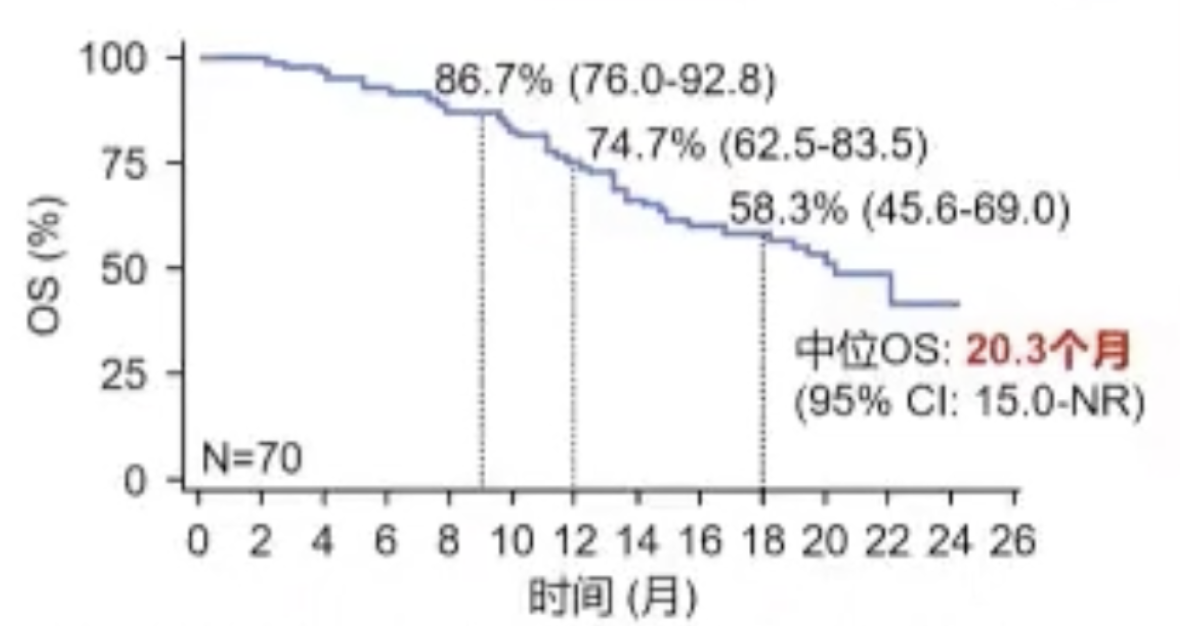
为了进一步确认该治疗方案的疗效,3期研究正在进行。
一线联合治疗:卡瑞利珠单抗+化疗
该研究为一项单臂,多中心,2期研究,纳入34例晚期HCC和47例晚期BTC初治患者,接受卡瑞利珠单抗+FOLFOX4/GEMOX方案(Q2W)一线治疗,主要终点为ORR和安全性。
结果显示,卡瑞利珠单抗+FOLFOX4/GEMOX方案一线治疗ORR为26.5%,DCR为79.4%,中位PFS为5.5个月,中位OS未达到。
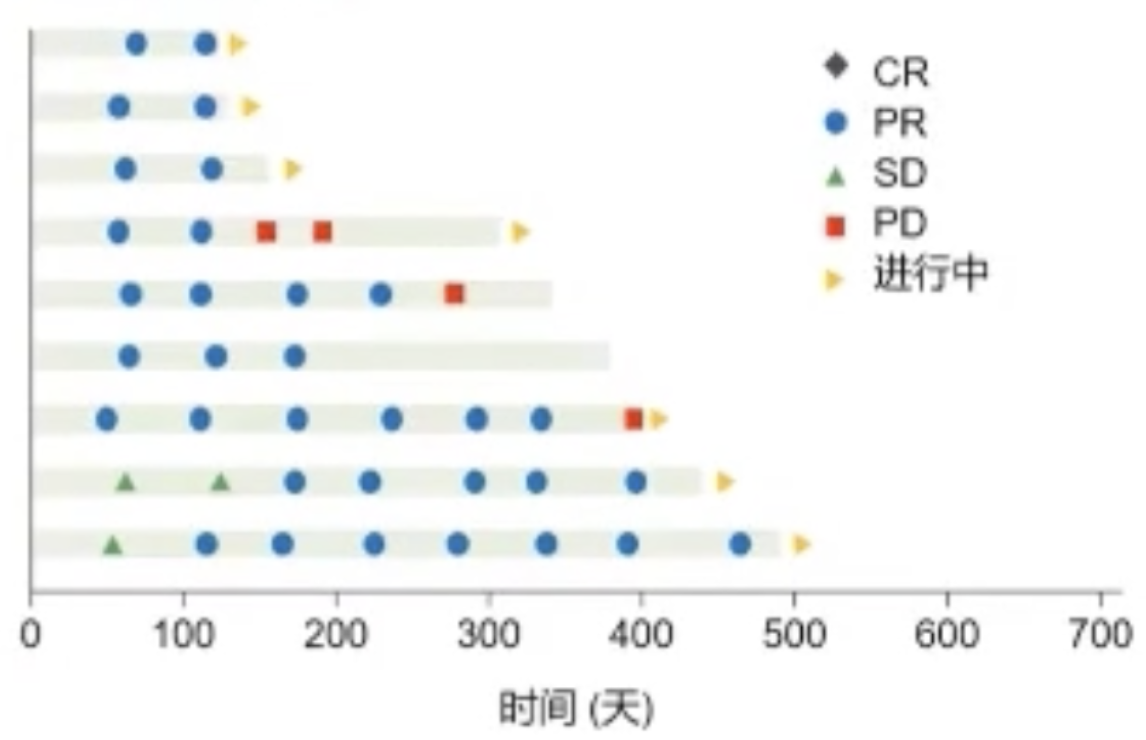
HCC肿瘤缓释情况.
一线联合治疗:信迪利单抗+IBI305 ORIENT-32研究
ORIENT-32是一项随机、开放标签的II/III期临床试验,在中国 50 个临床中心进行,同时美国等级临床试验,代码为NCT03794440,ORIENT-32旨在评估信迪利单抗联合IBI305一线治疗HCC与索拉非尼的疗效和安全性差异。
2019年2月11日至2020年1月15日期间,共纳入595名患者,其中24名患者被分配至II期安全试验,另外571名患者被随机分配接受信迪利单抗联合IBI305治疗(n=380)或索拉非尼治疗(n=191)。24名患者至少服用一剂研究药物(信迪利单抗或IBI305),客观缓解率(ORR)为25.0%(95%可信区间9.8–46.7),≥3级的治疗相关不良事件(TRAEs)为7例(29%)。
结果显示,中位随访时间为10个月,信迪利单抗联合IBI305组的IRRC评估,中位PFS为4.6个月(95%CI:4.1-5.7),较索拉非尼组的2.8个月显著延长。在第一次OS中期分析中,信迪利单抗联合IBI305组,中位OS未到达。
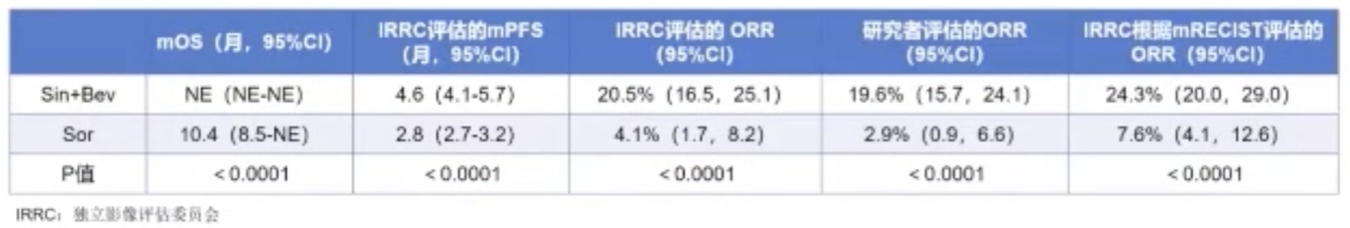
在安全性方面,最常见的3-4级TRAEs是高血压和手足综合征,信迪利单抗联合IBI305组与索拉非尼组的比例分别为55例(14%)VS 11例(6%)和 0 例 VS 22例(12%)。信迪利单抗联合IBI305组与索拉非尼组的严重不良事件发生率分别为123例(32%)和36(19%),其中导致死亡比例分别为6名(2%)和2名(1%)。
总之,免疫治疗在肝癌中的临床研究已经取得了很大的进展,然而在选择治疗方案时,应已目标导向为结果。多项研究显示,免疫治疗和系统治疗的组合更加适合转化降期。不管用什么方式,变化是主旋律,不变的是追求治愈的探索。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肝胆肿瘤#
77
学习了,谢谢分享
99