康宁杰瑞PD-L1/CTLA-4双特异性抗体获FDA孤儿药资格认定
2020-09-04 医药魔方 医药魔方
9月3日,康宁杰瑞宣布其自主研发的重组人源化PD-L1/CTLA-4 双特异性抗体KN046获美国FDA授予的孤儿药资格,用于治疗胸腺上皮肿瘤。这是康宁杰瑞继今年年初皮下注射PD-L1单域抗体KN03
9月3日,康宁杰瑞宣布其自主研发的重组人源化PD-L1/CTLA-4 双特异性抗体KN046获美国FDA授予的孤儿药资格,用于治疗胸腺上皮肿瘤。这是康宁杰瑞继今年年初皮下注射PD-L1单域抗体KN035获美国FDA授予胆道癌孤儿药资格之后获得的第二个孤儿药资格认证。
胸腺上皮肿瘤(TET)包括多种胸部肿瘤,主要包括胸腺瘤和胸腺癌。2020年在美国的患病人数约为7000~10000例。不可手术或转移性胸腺上皮肿瘤预后差,对于含铂药物化疗治疗失败的患者,目前尚无获批的标准治疗;后线化疗或靶向治疗的客观缓解率不足20%,多线治疗复发的患者中位生存期不足12个月,亟需有效的治疗药物提高患者疗效获益。研究表明胸腺是T细胞发育的重要器官,胸腺上皮肿瘤高表达PD-L1,因此有可能从免疫检查点抑制剂治疗中获益。
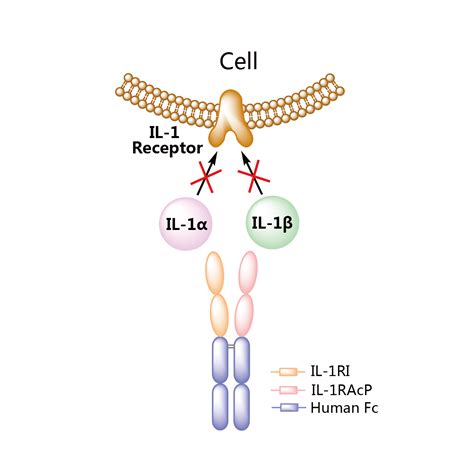
KN046是康宁杰瑞自主研发的全球首创重组人源化PD-L1/CTLA-4双特异性抗体,其创新设计包括:采用安全性显着提高的CTLA-4单域抗体;与PD-L1抗体融合组成双特异性抗体;可靶向富集于PD-L1高表达的肿瘤微环境及清除Treg。KN046的临床前和临床试验结果表明可显着减少对人体外周系统可能产生的毒副作用,有望成为突破性肿瘤免疫特效药。
KN046澳大利亚I期临床试验在胸腺上皮肿瘤患者中显示出了较高的响应率和持久的应答时间,安全性良好,KN046治疗胸腺癌的II期注册临床试验已于近日启动,预期将在中国和美国10余家研究中心同步开展。
美国FDA「孤儿药资格认定」源自 《孤儿药法案》(Orphan Drug Act,ODA),是FDA鼓励开发在美国患病人数低于 20 万疾病的创新药措施。凡获得孤儿药资格认定的新药,有机会获得 7 年市场独占权。除此之外,FDA对孤儿药还有临床研究费用享受50%税收减免、处方药用户BLA申报费减免以及FDA对研发资助和方案协助、快速审批通道等一系列的配套支持政策。2019年,FDA全年批准的48种新药中有21种(44%)是孤儿药; 销售额前十的癌症药物里,有8种在美国获得了部分适应症的孤儿药资格认定。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#特异性#
75
双特异性抗体是热点,但是也不一定都有效!
86
#PD-L1#
96
#CTLA-4#
94
#特异性抗体#
65