bioRxiv:陈薇院士/西湖大学周强合作,发现具有强新冠病毒中和能力的抗体,并成功解析复合物结构
2020-05-11 西湖大学 西湖大学
这项工作为靶向S蛋白N端结构域的药物设计和治疗策略提供了基础。
北京时间5月9日,军事医学科学院生物工程研究所陈薇院士团队和西湖大学周强团队合作,在预印版平台 bioRxiv 上线题为:A potent neutralizing human antibody reveals the N-terminal domain of the Spike protein of SARS-CoV-2 as a site of vulnerability 的研究论文。

陈薇院士团队从新冠康复病人的免疫细胞中筛选和鉴定了针对新冠病毒S蛋白的N端结构域,具有强病毒中和能力的单克隆抗体4A8,周强团队利用冷冻电镜解析了S蛋白与中和抗体4A8复合物的结构。
这项工作为靶向S蛋白N端结构域的药物设计和治疗策略提供了基础。
本次研究中,陈薇院士团队的研究人员从感染新型冠状病毒后康复病人的记忆B细胞和浆细胞中分离初筛抗体,获得了399种单克隆抗体。经过人体体外环境的抗原抗体亲和力检测,以及活病毒和假病毒(即无扩增能力,而保留了侵染能力的病毒)的中和实验后,发现抗体4A8具有强病毒中和能力,可以明显抑制病毒的活性。
随后,周强实验室利用冷冻电镜技术,成功解析了4A8抗体与新冠病毒S蛋白的高分辨率复合物结构,可以清楚的看到二者的相互作用界面。

新冠病毒S蛋白与单克隆抗体4A8复合物的冷冻电镜密度图(左)及结构图
研究显示,4A8抗体通过重链与新冠病毒S蛋白的氮端结构域(NTD)相结合。在复合物的结构中,他们解析了NTD结构域的3个柔性片段(意为构象容易发生变化的区域),在之前解析的新冠病毒S蛋白的结构中,这部分序列因为其柔性而未被解析。之后的结构分析发现,中和抗体4A8的可变区与其中的两个柔性片段相互作用,因而稳定了该部分结构。
S蛋白以三聚体形式存在,含有三个单体。每个S蛋白单体中的NTD都能被4A8结合,且相互作用界面并无差别。抗体的结合在空间上不会影响S蛋白受体结合区域(RBD)的位置及RBD与细胞表面受体ACE2的结合。
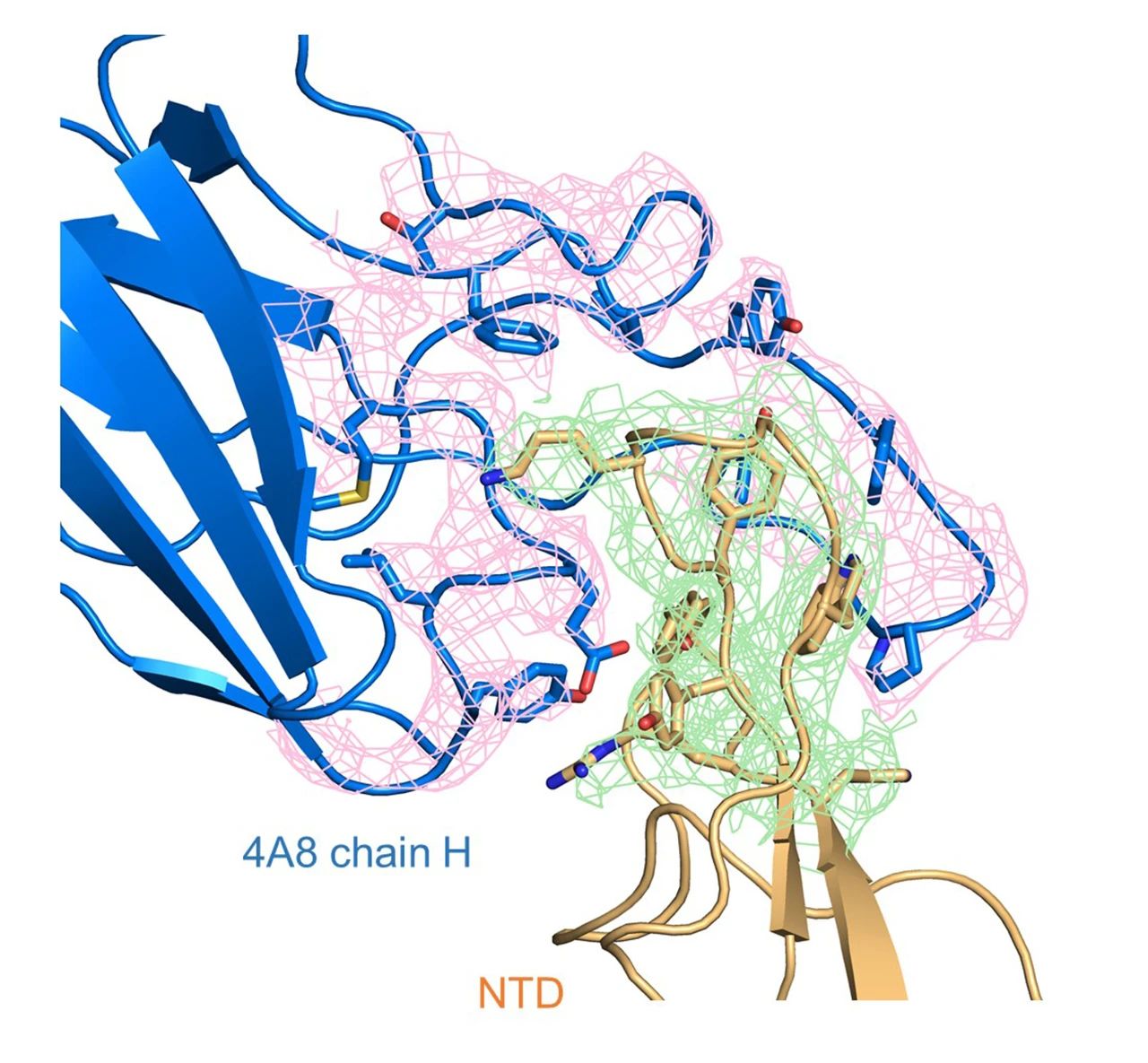
新冠病毒S蛋白的N端结构域(NTD)和4A8重链的相互作用界面密度示意图
此前,在针对新冠病毒的研究中,抗体设计、药物设计主要靶向新冠病毒S蛋白的RBD区域,鲜有针对S蛋白其它区域的靶向治疗策略。
这项研究成果,看清了4A8抗体与新冠病毒S蛋白的复合物结构,为靶向新冠病毒氮端结构域的药物设计和治疗策略提供了结构基础。
同时,4A8作为一种抑制病毒侵染人体细胞能力较强的抗体,也可以和作用于新冠病毒S蛋白其他区域的抗体联合使用,从而提高新冠治疗的成功概率。
这项研究也是西湖大学周强实验室继解析S蛋白与ACE2复合物三维结构后,在新冠研究领域的又一重要成果。

在此之前,3月4日,西湖大学周强实验室在 Science 发表论文,首次解析新冠病毒表面 S 蛋白受体结合结构域与细胞表面受体 ACE2 全长蛋白复合物的三维结构,展示了新冠病毒侵染人体细胞的详细过程,这一成果被选为当期 Science 封面论文。
原始出处:
Xiangyang Chi, Renhong Yan, Jun Zhang, et al. A potent neutralizing human antibody reveals the N-terminal domain of the Spike protein of SARS-CoV-2 as a site of vulnerability. bioRxiv, 2020.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#解析#
70
#Bio#
49
#复合物#
57
新冠肺炎,疫情何时才能消失
86
院士是学术至高点,也是大家必争之地呀
64