脑卒中遗传学研究重磅突破:为未来脑中风的药物研发奠定了基础
2022-11-09 神经科学临床和基础 神经科学临床和基础
脑卒中是全世界第二大死亡原因,既往脑卒中的全基因组关联研究(GWAS)主要在欧洲血统的人群中进行。
研究摘要
脑卒中是全世界第二大死亡原因,既往脑卒中的全基因组关联研究(GWAS)主要在欧洲血统的人群中进行。在对110,182名卒中患者(5个祖先,33% 非欧洲人)和1,503,898名对照个体的跨血统 GWAS 荟萃分析中,研究人员在89个(61个是新的)独立基因座上鉴定出了卒中及其亚型的关联信号: 60个信号在主要的逆方差加权分析中发现,29个信号在次要的元回归和多特征分析中发现。在89,084例卒中(30% 非欧洲)和1,013,843例对照个体的内部交叉祖先验证和独立随访的基础上,他们重复了87% 的主要卒中风险位点和60% 的次要卒中风险位点(p < 0.05)。效应大小在不同祖先之间是高度相关。跨血统作图、芯片突变分析及转录组和蛋白质组范围的关联分析进一步验证了假定的致病基因(如 SH3PXD2A 和 FURIN)及其变体(如 GRK5和NOS3)。使用如上三管齐下的方法,研究人员为推定的药物效应提供遗传证据,他们提出 F11,KLKB1,PROC,GP1BA,LAMC2和VCAM1作为脑卒中治疗的可能靶点,且目前已经有研究人员在研究靶向于 F11和 PROC 的中风药物。整合跨血统和血统特异性卒中 GWAS 与血管危险因子 GWAS (综合多基因评分)的多基因评分有效预测了欧洲,东亚和非洲血统人群中的缺血性卒中。在52,600名心脏代谢疾病的临床试验参与者中,卒中遗传风险评分可以独立于临床风险因素精准预测缺血性卒中的发生风险。本研究的研究结果为卒中生物学提供了坚实的遗传学基础,揭示了潜在的药物靶点,并开发出了跨越祖先的脑卒中遗传风险预测工具。
研究背景和研究方法
中风是全球第二大死亡原因,约占总死亡人数的12%,尤其是在低收入国家,其负担越来越重。中风的特点是突发性神经功能缺陷,主要由脑缺血引起(其中主要的病因亚型为大动脉动脉粥样硬化性中风(LAS)、心源性卒中(CES)和小血管中风(SVS),以及较少发生的脑出血(ICH))。与欧洲人群相比,亚洲和非洲人群中SVS和ICH的患病率更高,这说明了不同血统人群中风亚型的发生频率不同。大多数与中风相关的基因位点已在欧洲血统人群中确定。迄今为止发表的最大的GWAS荟萃分析(67162例和454450名对照个体,MEGASTROKE)报告了32个中风风险位点。为了确定新的遗传关联,并拓宽中风发病机制和假定药物靶点的认知视野,研究人员首先对1614080名参与者进行了跨血统GWAS(其中包括110182名中风患者),然后在89084名中风患者和1013843名对照个体的独立数据集中重复了之前全基因组的显著基因座信号。然后,他们通过利用表达和蛋白质数量性状基因座、交叉祖先精细作图以及与其他性状共享遗传变异来确定已识别的中风风险基因座。最后,他们使用了一系列基因组学驱动的中风预防和治疗药物发现方法,并在基于人群的研究和临床试验的背景下,评估了多基因评分(PGSs)对中风的预测价值。 Fig. 2 Effect-size comparison across ancestry groups of lead variants
Fig. 2 Effect-size comparison across ancestry groups of lead variants
identified in stroke GWASs and cross-ancestry fine-mapping.
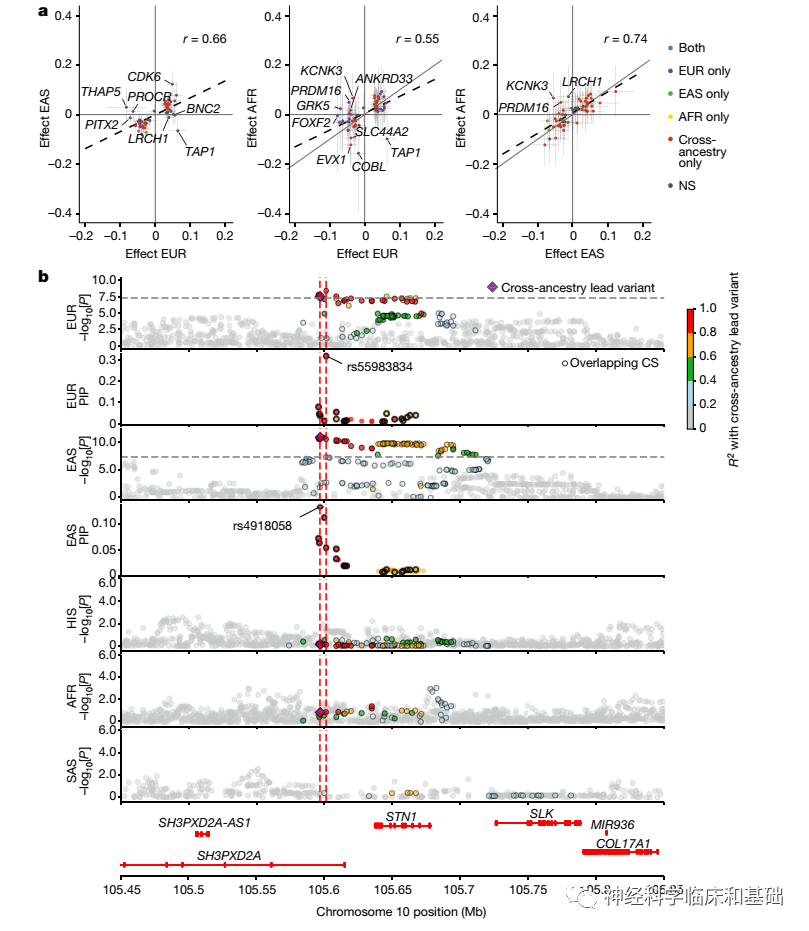 Fig. 3 Genomics-driven drug discovery.
Fig. 3 Genomics-driven drug discovery.
 Fig. 4 Risk prediction in a population and trial setting.
Fig. 4 Risk prediction in a population and trial setting.
 研究创新点一
研究创新点一
鉴定了89个(61个是新的)与卒中及其亚型相关的独立基因座。提出了F11,KLKB1,PROC,GP1BA,LAMC2和 VCAM1可作为脑卒中治疗的药物靶点。
研究创新点二
广泛的生物信息学分析确定了将来功能性研究中优先考虑的基因。如SH3PXD2A和FURIN。
研究创新点三
该项研究结果为使用三种独立的方法推测药物效应提供了遗传学证据,其中两种方法(基因富集分析和基于pQTL的MR)对靶向F11和KLKB1的药物结果获得很好的一致性。F11和F11a抑制剂(如阿贝拉西单抗、BAY 2433334和BMS-986177)目前正在一级或二级卒中预防的二期试验中进行检测(NCT04755283、NCT04304508、NCT03766581)。基于pQTL的MR提示PROC是中风的潜在药物靶点。在1期和2期试验(3K3A-APC,NCT02222714)中,发现人类活化蛋白C的重组变异体(由PROC编码)在溶栓、机械取栓或两者同时进行后治疗急性缺血性中风是安全的,并准备进行即将到来的3期试验。3K3A-APC被认为是一种神经保护剂,有证据表明其可以保护白质束和少突胶质细胞免受小鼠缺血损伤。GP1BA、VCAM1和LAMC2作为中风的潜在药物靶点的证据较弱,只有一个pQTL数据集中有共定位的证据。
研究不足
该项研究对绝大多数已确定的全基因组显著关联进行了独立验证,并根据这些发现按置信水平对基因座进行了分级。尽管随访研究样本规模显著,有近90000名中风患者,但该分析仍然不够有力,尤其是对于低频变异、血统与亚型特异性关联的分析上。该研究大多数随访研究都来自大型生物库,根据电子健康记录确定事件,而没有合适的中风亚型信息。在有中风病史的临床试验参与者中,微弱的风险预测可能指向选择或指标事件偏见和二级预防治疗的影响。
研究的主要意义
该研究从全球超过200000名中风患者中获得的基因组研究结果为未来中风发病机制的生物学研究奠定了重要的遗传学基础,该项研究不仅鉴定出了潜在的干预药物靶点,还为跨家族遗传风险预测提供了有力工具。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言