Cell子刊:中山大学兰平等发现空肠弯曲杆菌衍生的细胞致死膨胀毒素促进结直肠癌转移!
16小时前 iNature iNature 发表于陕西省
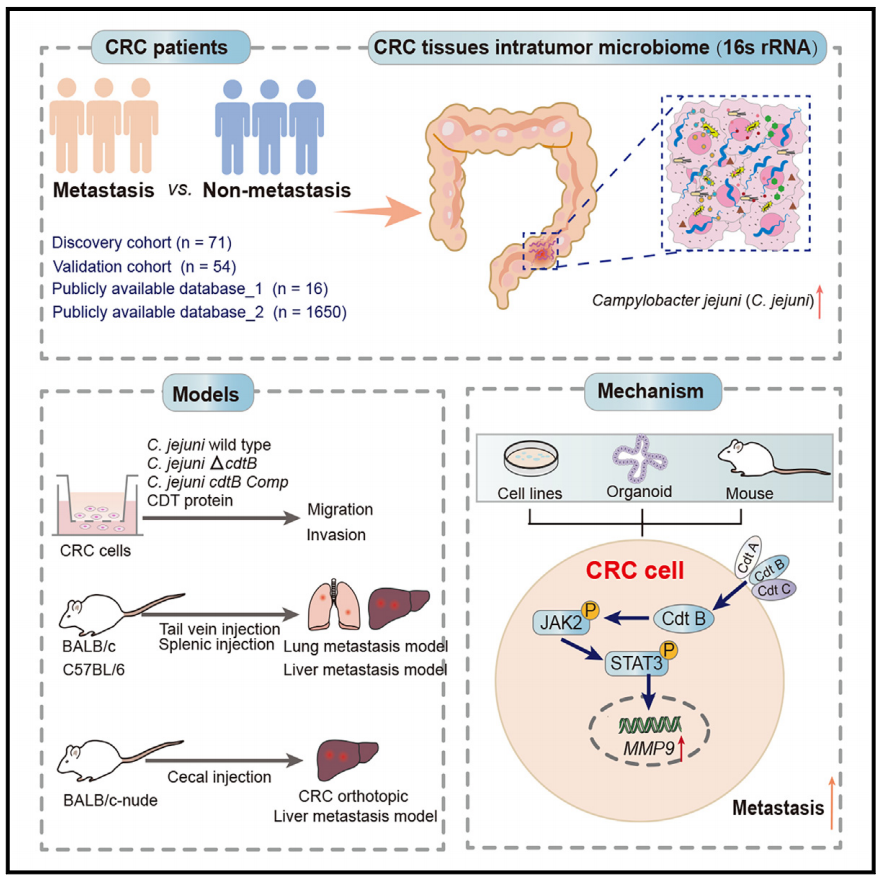
该研究发现空肠弯曲杆菌衍生的细胞致死膨胀毒素促进结直肠癌转移。
各种形式的实体肿瘤都有细胞内细菌,但这些微生物的生理后果尚不清楚。
2024年12月2日,中山大学兰平、扬州大学黄金林、美国佛罗里达大学Christian Jobin共同通讯在Cell Host & Microbe在线发表题为“Campylobacterjejuni-derived cytolethal distending toxin promotes colorectal cancer metastasis”的研究论文,该研究发现空肠弯曲杆菌衍生的细胞致死膨胀毒素促进结直肠癌转移。
研究发现弯曲杆菌在转移患者的原发性结直肠癌(CRC)病变中显著富集。在肝或肺转移小鼠模型中,空肠弯曲杆菌衍生的细胞致死膨胀毒素(CDT)通过JAK2-STAT3-MMP9信号通路促进结直肠癌转移,这在空肠弯曲杆菌感染的人类结肠组织和CDT治疗的结肠类肿瘤患者中得到证实。cdtB (ΔcdtB)或纯化cdtB蛋白的基因缺失表明,基因毒素对空肠梭菌的促转移性至关重要。在C. jejuni定植的小鼠中,产生CDT的C. jejuni向肠外植入肿瘤的易位增加可能导致这些肿瘤的加速转移。总之,这些发现表明,肿瘤内细菌来源的基因毒素加速肿瘤转移,可能为癌症管理开辟新的诊断和治疗途径。

结直肠癌(CRC)患者通常在原发肿瘤诊断后5年内发生远处转移,并且这种情况是全球癌症相关死亡率的主要原因。遗憾的是,目前用于治疗转移性患者的治疗方式有限,了解导致这种情况的潜在机制可能对癌症生存产生巨大影响。已经发现肠道细菌组影响各种癌症的发生和进展,包括CRC。细菌影响癌症连续性的过程是多因素的,包括,例如,细菌衍生的分子,如基因毒素、短链脂肪酸、吲哚和胆汁酸衍生物,它们改变免疫、代谢和宿主DNA完整性。细菌组和宿主之间的相互作用可以以细胞外源性方式进行,例如,粪便细菌影响周围细胞(上皮和粘膜免疫细胞)的活性,以及内在方式进行,细胞内微生物直接改变细胞生理。
一些致瘤前细菌,如核梭杆菌(F. nucleatum)、基因毒性大肠杆菌(E. coli)和产肠毒素的脆弱拟杆菌(B. fragilis),都与促进癌症转移有关。例如,F. nucleatum的凝集素Fap2通过与肿瘤细胞上显示的Gal-GalNAc相互作用介导其在乳腺癌中的定植,而Gal-GalNAc与小鼠乳腺癌转移有关。此外,脆弱芽胞杆菌可通过分泌脆弱芽胞杆菌毒素(BFT)刺激乳腺癌转移,从而激活β-catenin-Notch1通路。然而,基因毒素产生细菌与癌症转移之间的关系尚不清楚。
机理模式图(图源自Cell Host & Microbe)
细胞致死膨胀毒素(CDT)是一类细菌来源的基因毒素,由各种弯曲杆菌、埃希氏菌、幽门螺杆菌和沙门氏菌产生。宿主细胞内化这种毒素会引起DNA损伤和细胞周期阻滞。有趣的是,与正常邻近组织相比,弯曲杆菌在CRC病变中富集,CDT在CRC临床前模型中表现出致瘤性。然而,CDT与CRC转移之间的关系尚不清楚。
在这里,研究人员证明肿瘤内弯曲杆菌在转移性结直肠癌中富集,通过亚基CdtB促进癌症转移。该酶亚基导致肿瘤细胞中多种基质金属蛋白酶(MMPs)的表达增加和Janus激酶2 (JAK2)-信号转导和转录激活因子3 (STAT3)信号的激活。重要的是,肠道中产生CDT的空肠弯曲杆菌可能潜在地转移到肠外肿瘤病变,加速转移进展。这些发现可能有助于设计癌症患者的预后生物标志物。重要的是,JAK2/STAT3/ MMP9通路参与CDT诱导的癌症转移的发现可能具有潜在的治疗应用。
参考消息:
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(24)00437-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#结直肠癌# #空肠弯曲杆菌#
6