目前多种治疗方案已获批用于不可切除的肝细胞癌(HCC)。当无禁忌证时,应高度考虑将含免疫检查点抑制剂(ICI)的方案作为一线治疗,尤其是对于肝炎病毒相关HCC患者,因为与索拉非尼相比,该方案的总生存期(OS)较优。在所有含ICI的方案中,阿替利珠单抗加贝伐珠单抗,以及度伐利尤单抗加tremelimumab(曲美木单抗,替西木单抗)仍然是首选方案,除非存在其中任何一种药物的禁忌证。尽管索拉非尼仍然是目前唯一获批用于特定Child-Pugh(CP)B HCC患者一线治疗的药物,但阿替利珠单抗加贝伐珠单抗正在该患者群体中进行研究。此外,肝移植后复发的患者可能获益于酪氨酸激酶抑制剂(TKI),仍需要更多的研究来确定ICI在这种情况下的安全性。有趣的是,多种潜在的生物标志物,包括肿瘤突变负荷(TMB),微卫星不稳定性(MSI)状态和PD-L1表达水平,对HCC患者ICI反应预测不一致。在ICI进展后,可用于指导后线治疗选择的证据有限,应根据治疗方案的安全性和患者偏好做出决定。正在进行多项试验以阐明最佳治疗顺序。我们认为在后线治疗中TKI(如卡博替尼、瑞戈非尼、仑伐替尼和索拉非尼)可能更有益,可扩大对血管内皮生长因子(VEGF)以外的其他通路的抑制。当常规治疗方案用尽时,组织活检可能有助于揭示罕见的可靶向突变,如RET基因融合。
研究背景
肝细胞癌(HCC)是全球癌症相关死亡的第三大常见原因,每年导致80多万例死亡。在美国,HCC是癌症相关死亡的第六大常见原因,预计2023年有3万例死亡。HCC的病因主要分为病毒相关[乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)]或非病毒相关(酒精性和非酒精性肝炎)。
对于不适合局部区域治疗的晚期HCC,TKI(索拉非尼和仑伐替尼)是主要一线治疗选择,与安慰剂相比,生存结局有所改善。随着ICI的出现,有了更新的治疗选择,包括2018年的阿替利珠单抗联合贝伐珠单抗(atezo/bev),以及2022年的度伐利尤单抗联合tremelimumab(曲美木单抗,替西木单抗)(durva/treme)。
尽管这些批准为患者带来了巨大益处,有几个问题尚未得到解答,其中一个是在晚期HCC中如何确定这些疗法的顺序。本文讨论了目前塑造晚期HCC全身治疗格局的研究,并阐明这一领域的难题。
一线治疗
免疫检查点抑制剂(ICI)
已探索了多种基于ICI的方案作为晚期HCC的一线治疗,只有两项试验导致FDA批准:IMbrave 150和HIMALAYA。IMbrave 150(NCT03434379)是一项III期国际随机对照试验(RCT),比较了程序性死亡配体1(PD-L1)抑制剂阿替利珠单抗+VEGF抑制剂贝伐珠单抗vs索拉非尼。这是第一个显示总生存期(OS)优于索拉非尼的联合疗法,atezo/bev组为19.2个月,索拉非尼组为13.4个月[风险比(HR)0.66;95%置信区间(CI)0.52-0.85]。无进展生存期(PFS)也从4.3个月延长至6.9个月(HR 0.65;95%CI 0.53–0.81)。这导致atezo/bev获批作为该患者群体的一线治疗选择。值得注意的是,亚组分析表明,OS获益仅限于病毒性肝炎相关HCC患者。此外,与较差的生存结局相关的甲胎蛋白(AFP)水平>400的患者似乎从该方案中获益较少。HIMALAYA(NCT03298451)是另一项III期国际RCT,比较了另一种PD-L1抑制剂度伐利尤单抗联合或不联合细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抑制剂替西木单抗vs索拉非尼。发现该联合疗法在OS方面优于索拉非尼(16.4 vs 13.8个月;HR 0.78;95% CI 0.65–0.93),在PFS方面没有差异(3.8 vs 4.1个月;HR 0.90;95% CI 0.77–1.05)。两项III期研究正在评估程序性细胞死亡蛋白1(PD-1)/PD-L1和CTLA-4抑制剂双免疫疗法的益处:CheckMate 9DW(NCT04039607)比较伊匹木单抗+纳武利尤单抗(ipi/nivo)vs索拉非尼或仑伐替尼,以及TRIPLET(NCT05665348)比较atezo/bev+伊匹木单抗 vs atezo/bev,预计到2025年有初步结果。表1总结了已完成的主要的和正在进行的一线治疗RCT。
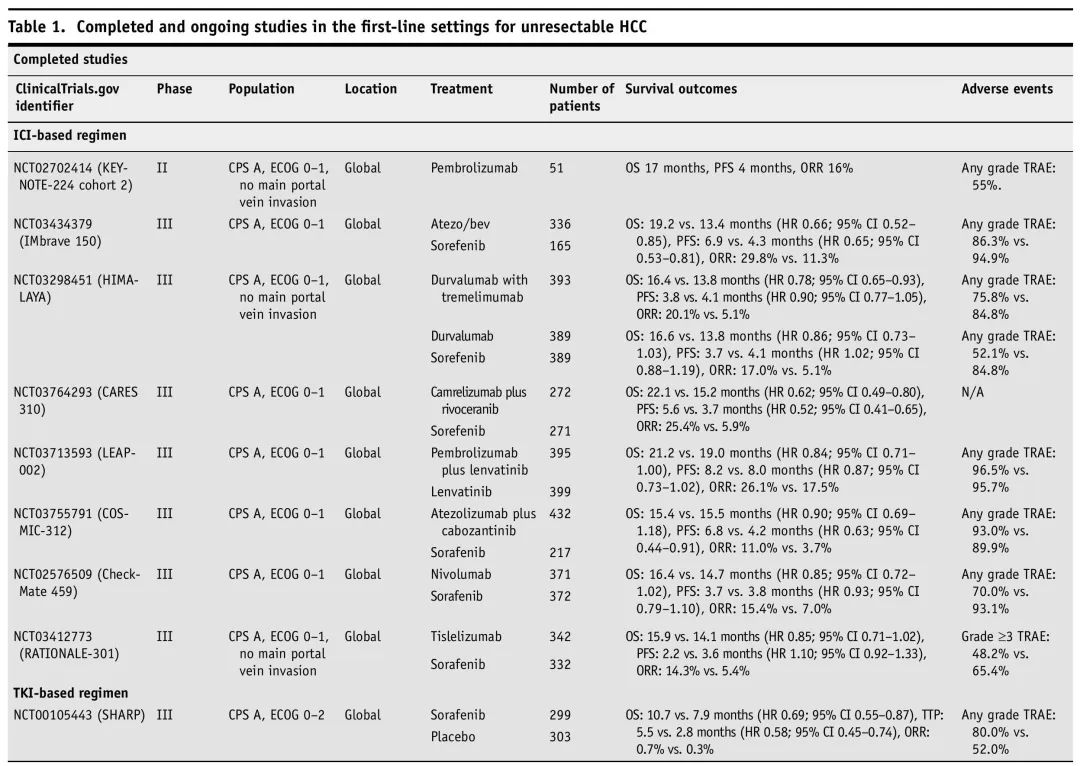
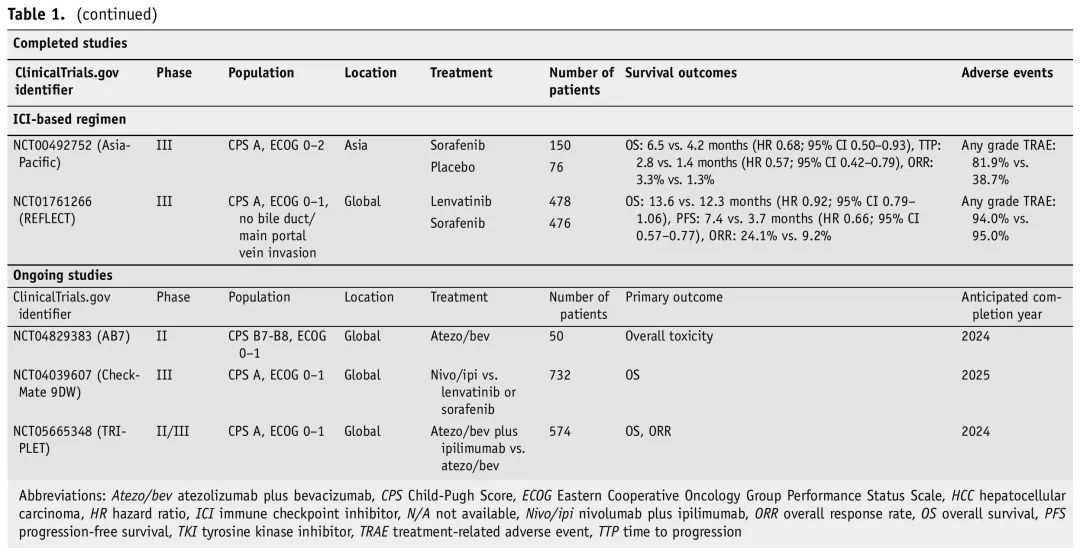
表1. 已完成的和正在进行的不可切除HCC一线治疗研究
几项试验探索了ICI与TKI联用能否协同改善生存结局。不幸的是,这些研究的结果大多令人失望。LEAP-002(NCT03713593)是一项III期RCT,比较了PD-1抑制剂帕博利珠单抗+抗血管生成TKI仑伐替尼vs单独仑伐替尼。该试验错过了预先设定的主要终点OS和PFS。这可能是由于联合治疗组(18.0%)的停药率高于单药治疗组(10.6%)。此外,单药治疗组的总生存期显著优于先前研究仑伐替尼单药治疗的RESCOPE试验(NCT01761266)(19.0 vs 13.6个月)。COSMIC-312(NCT03755791)是一项III期RCT,评估了阿替利珠单抗和卡博替尼(另一种抗血管生成TKI)联合治疗。尽管与索拉非尼相比,联合用药组的PFS显著较优,但OS没有显著较优。有趣的是,最近的III期RCT CARES 310(NCT03764293)显示,PD-1抑制剂卡瑞利珠单抗+口服抗VEGF受体2(VEGFR2)TKI阿帕替尼的OS和PFS优于索拉非尼(HR 0.62;95%CI 0.49–0.80 vs HR 0.52;95%CI 0.41–0.65)。该联合疗法的新药申请(NDA)已提交FDA。值得注意的是,该研究中的大多数患者为HBV相关HCC(CARE 210为74.6%,LEAP-002为48.5%,COSMIC-312为29.3%)。
ICI单药治疗作为一线治疗不如联合治疗有效。HIMALAYA试验显示,度伐利尤单抗单药治疗不劣于索拉非尼,OS和PFS与durva/treme相似(度伐利尤单抗 vs durva+treme的OS/PFS分别为16.6 vs 16.4个月和3.7 vs 3.8个月)。然而,该研究并非旨在探索度伐利尤单抗和durva/treme组的差异。RATIONALE-301研究也显示PD-1抑制剂替雷利珠单抗不劣于索拉非尼,OS分别为15.9个月和14.1个月(HR 0.85;95%CI 0.71–1.02),PFS分别为2.2个月和3.6个月(HR 1.10;95%CI 0.92–1.33)。KEYNOTE-224 (NCT02702414)是一项帕博利珠单抗单药治疗的单臂II期研究,结果显示,OS为17个月,PFS为4个月。然而,CheckMate 459(NCT02576509)并未显示纳武利尤单抗相比索拉非尼改善了OS,其加速批准被FDA撤回。因此,对于对TKI、抗VEGF疗法有禁忌证或不耐受,或医学上不适合ICI联合治疗的患者,目前单药ICI可能是一种选择,但根据上述可及数据,无法对单药疗效得出广泛的结论。
晚期HCC治疗的一个主要限制是,上述试验的绝大多数受试者为CP A肝硬化患者。约20%的新诊断HCC患者存在CP B或C肝硬化。因此,考虑治疗是否适合CP A以外HCC是非常有意义的。一项回顾性研究纳入了48例接受atezo/bev治疗的CP B肝硬化患者,结果显示,与CP A肝硬化患者相比,治疗相关不良事件相似。基于此,一项atezo/bev用于CP B7-B8肝硬化患者的前瞻性II期研究正在进行中(AB7—NCT04829383)。此外,在HIMALAYA试验招募的患者中,有1-2%存在CP B7肝硬化。然而,该亚组的结局尚未单独报告。需要进一步的durva/treme数据来确定在该患者群体中的有效性和安全性。
由于这些方案之间没有头对头比较,因此通常根据耐受性和医学合并症来选择治疗方案。IMbrave 150纳入了门静脉主干或门静脉侧支侵犯(Vp4)的患者,因此,atezo/bev是这些患者的合理选择。此外,对于存在自身免疫性疾病的患者,与双药ICI相比,单药ICI引起自身免疫性疾病发作的风险可能较低,倾向于atezo/bev。
对于对贝伐珠单抗有禁忌证或担忧的患者,可考虑durva/treme。贝伐珠单抗的主要副作用包括出血或血栓形成、肾病综合征、充血性心力衰竭、胃肠道穿孔或高血压失控的风险升高。该方案也可免除治疗前内镜检查,因为其未包含在HIMALAYA试验设计中。这对于未治疗或未完全治疗的食管静脉曲张患者有用,这些患者被排除在IMbrave 150研究之外。
酪氨酸激酶抑制剂(TKI)
过去,在晚期HCC的一线治疗中,TKI是标准也是唯一可及的治疗。SHARP(NCT00105443)和Asia-Pacifc(NCT00492752)是最早表明在CP A和一小部分(3.1%)CP B肝硬化HCC患者中,索拉非尼优于安慰剂的两项III期RCT。这导致索拉非尼在近十年内一直是全身治疗的单一支柱,直到III期REFLECT试验显示,仑伐替尼的OS不差于、PFS和ORR优于索拉非尼(OS 13.6 vs 12.3个月;HR 0.92;95% CI 0.79–1.06和PFS 7.4 vs 3.7个月;HR 0.66;95% CI 0.57–0.77)。值得注意的是,REFLECT研究排除了Vp4和CP B肝硬化患者,事后分析显示,仑伐替尼治疗期间进展为CP B的患者相比保持CP A的患者不良事件和停药率较高。相比之下,观察性GIDEON研究显示,索拉非尼在CP A vs CP B肝硬化患者中的药物相关3级或4级不良事件发生率相似(26% vs 22%)。
TKI对肝移植后复发的HCC患者也有用。一项纳入了接受实体器官移植并接受ICI治疗的患者的回顾性研究显示,同种异体移植的总体排斥率为41%。肝移植相似,为39%。因此,这类患者使用ICI风险较高,在获得更多数据之前,TKI是一种更安全的选择。索拉非尼和仑伐替尼都有相关数据。
ICI vs TKI
数据表明atezo/bev优于索拉非尼,尚未有RCT将其与仑伐替尼进行直接比较。几项小型回顾性研究分析了一线治疗中atezo/bev的OS和PFS是否优于仑伐替尼,结论相互矛盾。目前最大的相关真实世界研究包括了2000多例接受atezo/bev或仑伐替尼治疗的患者,发现两种方案的生存结局没有差异。有趣的是,atezo/bev显著改善了病毒相关HCC患者的OS,而仑伐替尼在非酒精相关HCC患者中显著较优。这种HCC病因相关的获益差异也见于一线治疗RCT。在IMbrave150和HIMALAYA的亚组分析中,atezo/bev和durva/treme的OS和PFS获益主要由HBV/HCV相关HCC驱动,较少由非病毒相关HCC驱动。病因不同的患者对ICI的反应存在差异或可由不同的潜在病理生理学解释。一项研究分析了23例HBV相关HCC手术标本,发现存在大量表达较高PD-1水平的调节性T(Treg)细胞和CD8+常驻记忆T细胞,诱导整体免疫抑制肿瘤微环境。在其他研究中,慢性HCV感染也与过度表达免疫抑制标志物(包括PD-1)导致的Treg浸润增加和慢性CD8+ T细胞衰竭有关。因此,在病毒相关HCC中,ICI靶向PD-1/PD-L1可以抑制免疫抑制Treg功能,启动抗肿瘤反应。另一方面,非酒精性脂肪性肝炎与肝内CD8+ PD-1+ T细胞增加和过度坏死性炎症导致正常肿瘤监视功能失调有关。从理论上讲,这使得PD-1 / PD-L1抑制剂效果降低,因为阻断PD-1/PD-L1会抑制该T细胞群的免疫反应。
多项研究探索了HCC中ICI反应预测生物标志物。PD-L1状态是研究最多的生物标志物之一,PD-L1阳性患者纳武利尤单抗和帕博利珠单抗的治疗反应较好。然而,atezo/bev和durva/treme没有观察到这种情况。相比之下,阳性联合分数(CPS)≥1%可预测atezo/bev疗效较好。TMB-H状态与对卡瑞利珠单抗加阿法替尼治疗有反应相关,但在atezo/bev治疗中未观察到这一相关性。虽然在实体瘤中dMMR/MSI-H状态与较高的ICI应答相关,但缺乏HCC的数据。此外,TMB-H(0.8%)和MSI-H(2.4%)的低发生率限制了这些生物标志物的临床效用。其他正在研究的生物标志物包括肿瘤浸润淋巴细胞、特定基因突变(CTNNB1、TP53、mSWI/SNF复合物)和细胞因子水平(TGF-β、IL-6和IL-27)。
后线治疗
基于ICI的治疗进展
由于ICI在HCC治疗领域相对较新,因此atezo/bev或durva/treme进展后二线和后线最佳治疗方案数据较少。一种方法是出于对免疫治疗耐药性的考虑,转换到TKI。一项回顾性研究纳入了53例患者,评估了atezo/bev进展后仑伐替尼疗效,中位OS为13个月,与一线REFLECT试验相似。一项前瞻性II期研究(NCT04588051)评估了atezo/bev后使用卡博替尼,OS为14.3个月。一项二线瑞戈非尼研究(REGONEXT—NCT05134532)正在进行中。表2展示了ICI进展后后线研究。
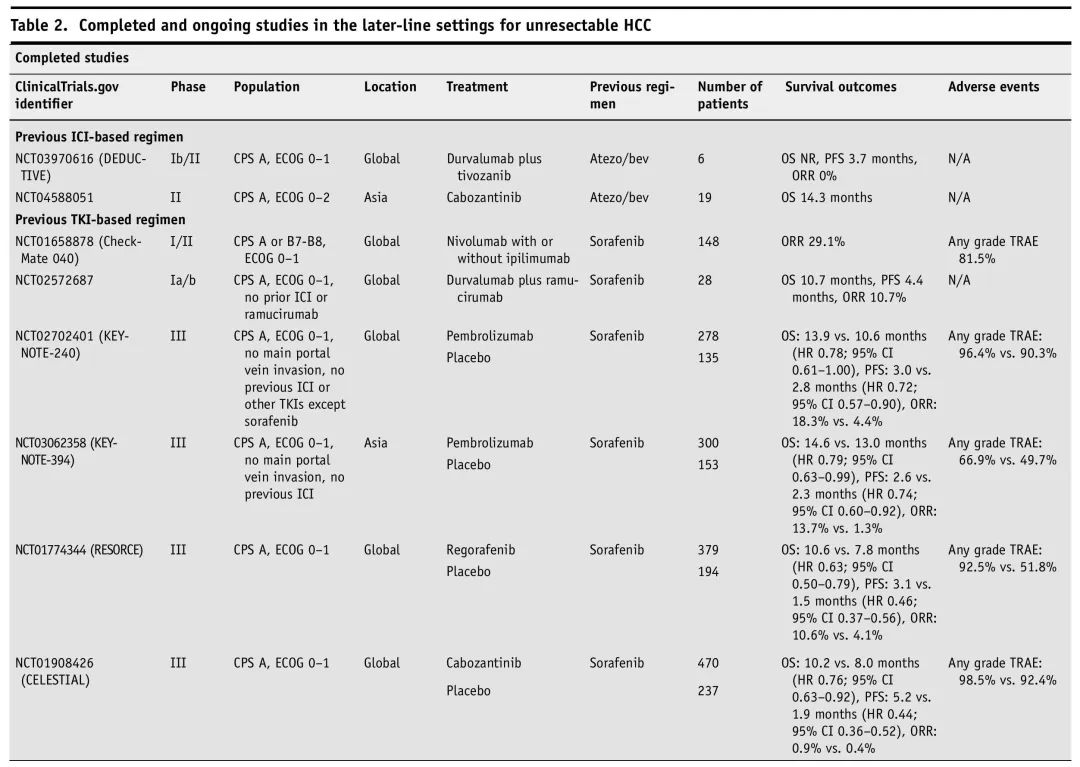
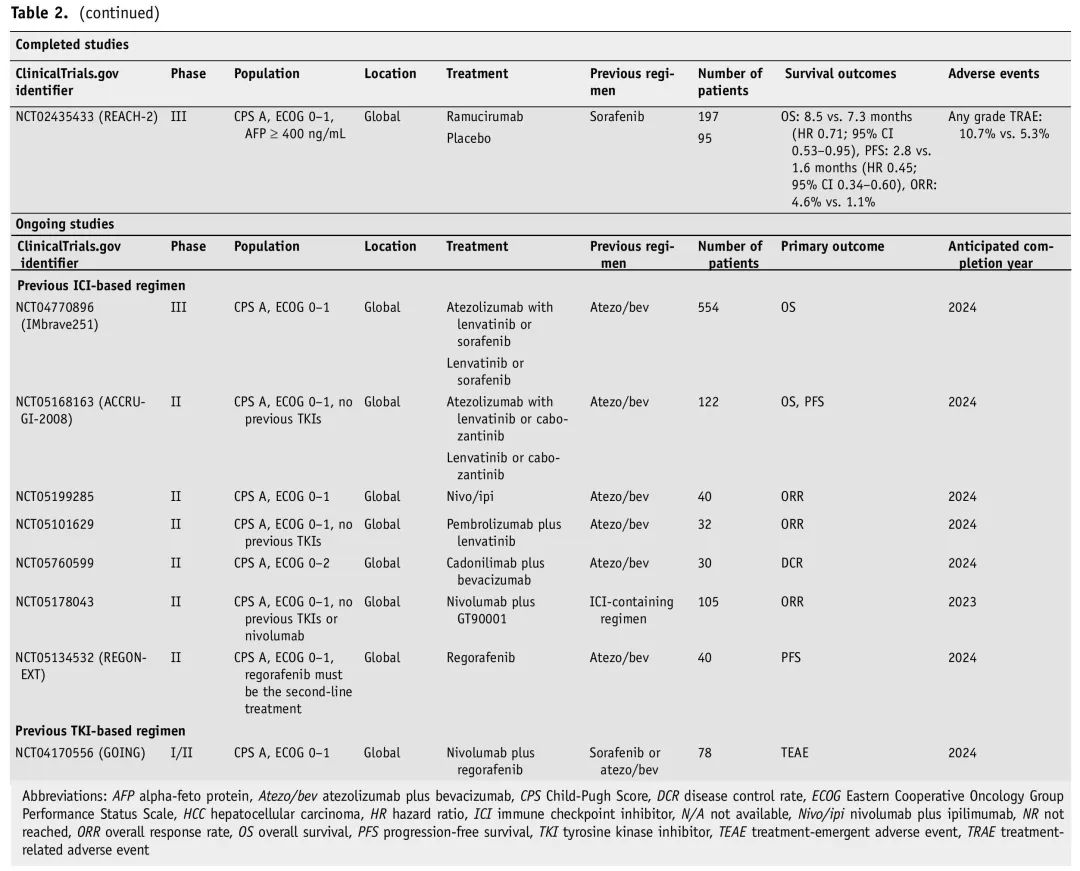
表2. 已完成的和正在进行的不可切除HCC后线治疗研究
另一种方法是继续使用ICI作为基础,将抑制范围从单独VEGF扩大到多种酪氨酸激酶。与分别仅靶向VEGF或VEGFR的贝伐珠单抗或雷莫芦单抗相比,仑伐替尼、索拉非尼、瑞戈非尼和卡博替尼可抑制多种酪氨酸激酶的功能,包括PDGFR、FGFR1-4、VEGFR1-3、RET、KIT和BRAF,如图1所示。在小鼠模型和体外研究中,这导致独立于VEGF-VEGFR抑制的抗肿瘤免疫增强,包括CD8+ T细胞活化增加,免疫抑制巨噬细胞和Treg群减少,与ICI协同发挥作用。NCT03970616是一项Ib/II期研究,纳入了21例既往未接受过治疗的患者和6例atezo/bev治疗后进展的患者接受度伐利尤单抗和VEGFR1-3抑制剂tivozanib(替沃扎尼)治疗。4/6例患者疾病稳定,1例患者疾病进展,尽管生存数据尚不成熟。IMbrave251(NCT04770896)是一项正在进行的III期RCT,比较了阿替利珠单抗+仑伐替尼或索拉非尼vs单独仑伐替尼或索拉非尼用于atezo/bev进展患者。表1列出了atezo/bev进展后其他联合疗法相关研究。
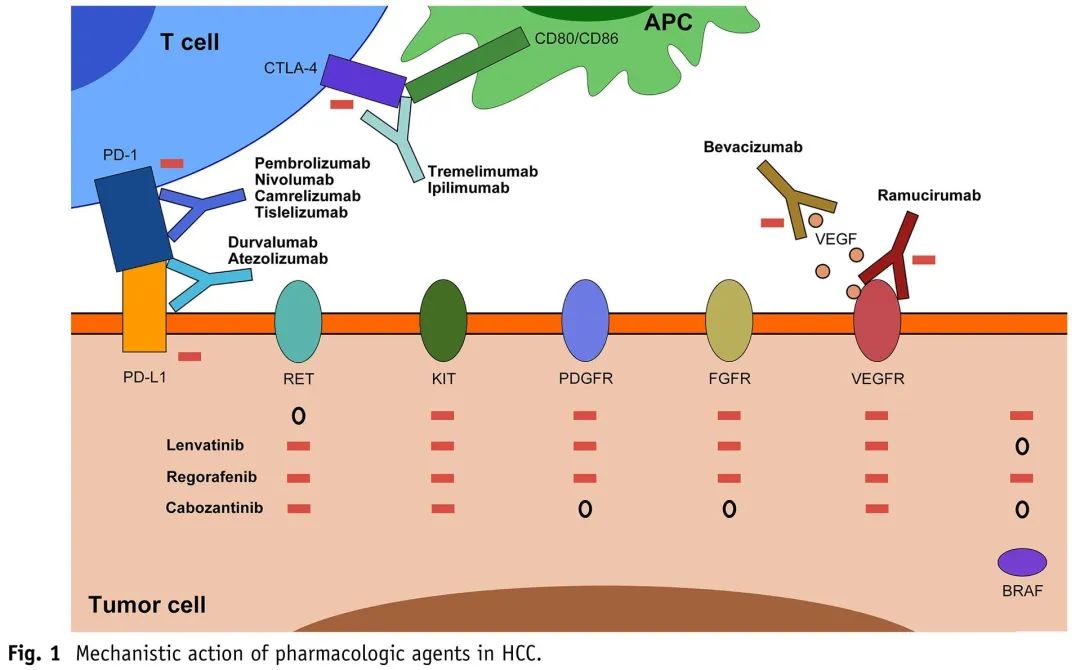
图1. HCC中药物作用机制
另一种考虑是将免疫检查点阻断从单抑制升级为双抑制。虽然支持HCC进展后双重免疫检查点阻断的数据有限,但在恶性黑色素瘤和非小细胞肺癌中,将抗CTLA-4抗体加入抗PD-1/PD-L1抗体可以克服耐药性。一项小型回顾性研究纳入了32例接受抗PD-1/PD-L1治疗作为一线治疗和ipi/nivo作为二线治疗的患者,结果显示,ORR为22%,无论HCC病因如何。目前正在进行两项试验来评估该方法的有效性:一线atezo/bev进展后ipi/nivo(NCT05199285)和atezo/bev进展后卡度尼利单抗(抗PD-1/CTLA-4双特异性抗体)+贝伐珠单抗(NCT05760599)。
不幸的是,目前,还没有大型随机研究评估durva/treme进展后的治疗选择,因为该方案最近才获批。预计对免疫治疗耐药,但需要进一步的研究来探索这一领域。鉴于数据缺乏,建议在基于ICI的方案进展后改用TKI,直到有进一步的研究评估后线治疗继续使用ICI的疗效。
基于TKI的治疗进展
与缺乏数据支持ICI进展后特定治疗相比,基于TKI的治疗进展后,有较多二线治疗数据。
多种索拉非尼进展后治疗方案得到了探索。III期RESORCE(NCT01774344)和CELESTIAL(NCT01908426)试验分别确定了瑞戈非尼和卡博替尼的OS和PFS获益(瑞戈非尼vs安慰剂:OS为10.6 vs 7.8个月,PFS为3.1 vs 1.5个月;卡博替尼vs安慰剂:OS为10.2 vs 8.0个月,PFS为5.2 vs 1.9个月)。REACH-2(NCT02435433)也支持在AFP≥400ng/mL患者中使用雷莫芦单抗,显示OS和PFS有所改善(雷莫芦单抗vs安慰剂:OS为8.5 vs 7.3个月,PFS为2.8 vs 1.6个月)。承认交叉试验比较的局限性,三种TKI的总生存期似乎相似(瑞戈非尼、卡博替尼和雷莫芦单抗的中位OS分别为10.6、10.2和8.5个月)。尽管没有随机研究评估仑伐替尼,一项回顾性研究纳入了30例一线索拉非尼治疗进展的患者,仑伐替尼的ORR为26.7%。
索拉非尼治疗进展后,含ICI的联合方案具有吸引力,尽管尚无批准。一项日本的回顾性研究显示,在既往接受过索拉非尼治疗的19例患者中,atezo/bev的ORR高达31.3%,在包括瑞戈非尼和雷莫芦单抗在内的所有二线治疗中,ORR最高。一项正在进行的I/II期试验(GOING,NCT04170556)显示,索拉非尼进展后,二线纳武利尤单抗加瑞戈非尼的安全性可控,但疗效结局尚未报道。一项关于度伐利尤单抗加雷莫芦单抗治疗多种癌症(包括28例HCC患者)的Ia/b期研究(NCT02572687)显示,OS为10.7个月,ORR为11%。I/II期CheckMate 040试验(NCT01658878)评估了Ipi/nivo,ORR达29.1%。单药ICI治疗的益处相对不明显,类似于一线治疗,支持通常需要ICI与其他药物联合来引发抗肿瘤反应。帕博利珠单抗在两项试验中显示出不同的结果。在国际KEYNOTE-240试验(NCT02702401)中,OS和PFS未达到其预先设定的统计阈值。然而,在亚洲进行的KEYNOTE-394(NCT03062358)中,OS、PFS和ORR显著较优(帕博利珠单抗vs安慰剂:OS为14.6 vs 13.0个月,PFS为2.6 vs 2.3个月,ORR为13.7% vs 1.3%)。重要的是,这两项研究中HCC病因不同:在KEYNOTE-240和KEYNOTE-394中分别有20.6%和79.5%的患者感染HBV。值得注意的是,尽管在HCC中纳武利尤单抗单药治疗的有效性值得怀疑,但研究表明,其在CP B7-B8肝硬化患者中具有良好的安全性。鉴于肝脏储备功能降低患者的全身治疗选择有限,在索拉非尼治疗进展的特定患者中,可考虑纳武利尤单抗。
几项研究探索了仑伐替尼进展后方案。日本的一项队列研究纳入了234例患者,在仑伐替尼进展、接受atezo/bev治疗的患者中,17.9%获得完全或部分缓解,在数值上高于其他治疗方案(索拉非尼、瑞戈非尼、雷莫芦单抗和卡博替尼)。但生存数据尚未报告。另一项规模较小的回顾性研究表明,在这种情况下,瑞戈非尼可能比索拉非尼更有效(PFS为3.2 vs 1.8个月,ORR为13.6% vs 1.8%)。由于数据缺乏,强烈建议TKI进展患者参加临床试验,特别是评估二线ICI的试验,鉴于其在HCC一线治疗中的有效性。
其他治疗方案
在HCC中,除了基于ICI和TKI的治疗外,还有其他可治疗靶点,尽管很少见,但可以利用。Dostarlimab(多塔利单抗)是一种靶向PD-1的单克隆抗体,在GARNET篮子试验(NCT02715284)中用于MSI-H或dMMR晚期恶性肿瘤患者。在2例接受多塔利单抗治疗的HCC患者中,一例部分缓解,另一例疾病进展。对于TMB-H患者,Ipi/nivo可能是一种有希望的选择。然而,CheckMate 9DW的进一步亚组分析正在等待中,值得注意的是,不到2%的HCC患者MSI-H或TMB-H。基于LIBRETTO-001研究(NCT03157128),携带RET基因融合的患者可能从塞普替尼中获益,但截至上次更新,尚未有HCC患者报名。一项大规模研究显示RET基因融合在HCC中罕见,1785例HCC患者中,只有0.06%携带RET基因融合。尽管如此,NCCN指南中仍然将其列为一种选择。在精准肿瘤学时代,存在许多靶向疗法,但不幸的是,与其他恶性肿瘤相比,研究未显示HCC中驱动突变富集。然而,应该承认,很多情况下,由于肝硬化能够仅通过成像诊断HCC,组织活检不可及。随着NGS和其他组织检测受到越来越多的关注,活检可能会变得更加重要,尤其对于晚期和后线HCC。因此,我们支持在可能时,进行肝或转移部位活检,来帮助指导治疗选择。
总 结
虽然晚期不可切除HCC患者的最佳治疗顺序尚未确定,但可考虑基于ICI的联合治疗作为一线治疗,除非有禁忌证。Atezo/bev和durva/treme都是可接受的选择,但副作用不同,可采用个体化策略。目前,对于CP B或肝移植后复发的患者,首选TKI作为一线治疗。在一线治疗进展后,对于一线接受基于ICI的方案的患者,可考虑TKI。对于一线使用TKI进展的患者,可考虑另一种TKI,包括仑伐替尼、索拉非尼、卡博替尼或瑞戈非尼。鉴于一项大型回顾性研究显示的真实世界临床疗效,也可考虑Atezo/bev,但需要进一步的试验来确定该方案在TKI治疗后的适用性。分子检测,包括TMB、MSI状态和PD-L1表达,在一线治疗中通常没有帮助,因为预测治疗反应的临床效用较低,但在后线治疗中,在基于ICI和TKI的方案用尽后,广泛的NGS检测可能有用。应鼓励患者在可行的情况下参加临床试验,以回答本综述中讨论的问题以及本综述范围之外的其他问题。
参考文献:
Ponvilawan, B., Roth, M.T. Sequencing Systemic Therapy in Hepatocellular Carcinoma. Curr. Treat. Options in Oncol. (2023). https://doi.org/10.1007/s11864-023-01135-7

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











晚期#HCC# #全身治疗#格局
71