眼科LHON病基因疗法LUMEVOQ两年营收近千万欧元,治疗4年后,视力显著改善
2022-02-02 药圈涛哥 生物药大时代
基因治疗在眼科领域的需求可期。疫情期间,一款眼科基因疗法LUMEVOQ 在法国临时使用授权下,两年卖了970万欧元,研究结果显示,LUMEVOQ治疗4年后,视力显著改善。
基因治疗在眼科领域的需求可期。疫情期间,一款眼科基因疗法LUMEVOQ 在法国临时使用授权下,两年卖了970万欧元,研究结果显示,LUMEVOQ治疗4年后,视力显著改善。
1月18日,GenSight Biologics(泛欧交易所代码:SIGHT)一家专注于开发和商业化治疗视网膜神经退行性疾病和中枢神经系统疾病的创新基因疗法的生物制药公司,公告显示,2021年,公司在法国的ATU下销售LUMEVOQ的收入为530万欧元,而2020年为440万欧元,尽管存在COVID情况,两年营收合计970万欧元。自2021年7月1日起追溯应用法国新的早期治疗法令确定的强制性折扣,以及根据IFRS15定期修订可变对价,已远远抵消了2021年最后一个季度。
GenSight bioologics致力于提供该药物,仅限于可用库存。双边注射的价格为每个患者70万欧元(不包括根据IFRS15的强制性折扣和可变考虑),预计在监管部门批准和正式报销之前,将在法国产生收入。
“我们在 2021 年的工作推动了 LUMEVOQ 的上市批准程序并推进了 GS030的临床开发,这使我们在进入 2022 年时处于有利地位。”GenSight Biologics 联合创始人兼首席执行官Bernard Gilly评论说,“这两种疗法的试验继续产生积极的数据,我们继续为在欧洲商业推出 LUMEVOQ 建立坚实的组织基础。我们相信 GenSight 将为其作为基因疗法领导者的下一阶段发展做好准备。”
LUMEVOQ的欧洲上市许可申请审查正在进行中,CHMP预计将在2022年第四季度做出决定。截至2021年12月31日,GenSightBiologics的现金和现金等价物总额为4430万欧元,而截至2021年9月30日为4910万欧元。
根据法国国家药品安全局(ANSM)批准的临时使用授权(ATU),更多患者在2021年最后一个季度获得了LUMEVOQ 的早期治疗。其中一些ATU于2021年第四季度申请并获得批准,患者计划于2022年初在巴黎Quinze-Vingts的CHNO接受治疗。因此,相关收入将在2022年第一季度相应确认。
LUMEVOQ治疗四年后,视力继续显著改善
1月24日,GenSight Biologics宣布遗传性视神经病变患者(LHON)接受LUMEVOQ治疗四年后,视力继续显著改善。研究结果来自RESTORE(CLIN06),该长期随访研究邀请了RESCUE和REVERSEIII期关键试验的参与者。
当RESTORE受试者加入研究时,在一次性注射2年后,他们已经经历了相对于他们的最佳矫正视力(BCVA)的最低点的有临床意义的改善:接受LUMEVOQ治疗的眼睛的视力在测评中可以达到+18.8ETDRS字母(一种视力评估对照的指标),而假治疗组(sham组,排除安慰剂效应)的视力为+17.3ETDRS字母;
治疗后4年,双侧从最低点持续改善,lumevoq治疗的眼睛在最低点平均改善为+22.5ETDRS字母,而假治疗的眼睛平均改善为+20.5 ETDRS字母。
这些结果对患者的影响可以通过在第4年相对于基线时自我报告的生活质量(QoL)得分的增加来证明。相对于基线,平均总体生活质量增加了一个有临床意义的幅度,这是由与心理健康和自主开展活动的能力相对应的有临床意义的子得分的增加驱动的(例如,角色困难、依赖性、远近活动、一般视力)。
“这项为期4年的RESTORE长期扩展研究为Leber遗传性视神经病变患者及其家属以及神经眼科社区提供了玻璃体内LUMEVOQ治疗的有效性和安全性的高信息量数据,”威尔斯眼科医院神经眼科服务主任、美国宾夕法尼亚州费城托马斯杰斐逊大学William H. Annesley EyeBrain中心创始董事兼CEO Robert Sergott博士说,“与LHON的自然史相比,4年的数据扩展并验证了3年的观察结果,确认了客观视力的改善是持续的,并与生活功能视觉质量的改善相关,而没有任何长期的安全问题。”
RESTORE是对一种罕见疾病治疗最大的长期随访研究之一,有62名受试者接受邀请加入。所有受ND4线粒体基因突变引起的LHON影响的受试者,均在一只眼内注射LUMEVOQ,另一只眼假注射。
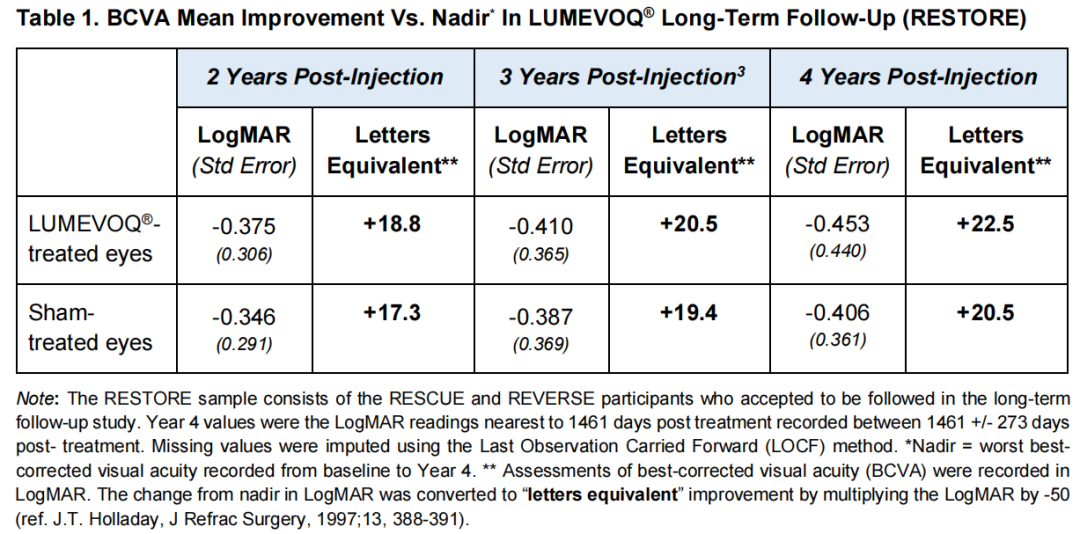
第4年的响应者分析表明,改善BCVA对很大一部分研究参与者是有益的。71.0%的RESTORE受试者在治疗4年后实现了临床相关恢复(CRR)相对最低点,其中80.7%的受试者一只或两只眼睛有图表上的视力(BCVA≤1.6LogMAR)。
与通常在未治疗患者中看到的视力趋势相反,这些发现代表了与LHON的自然进展的显着背离。
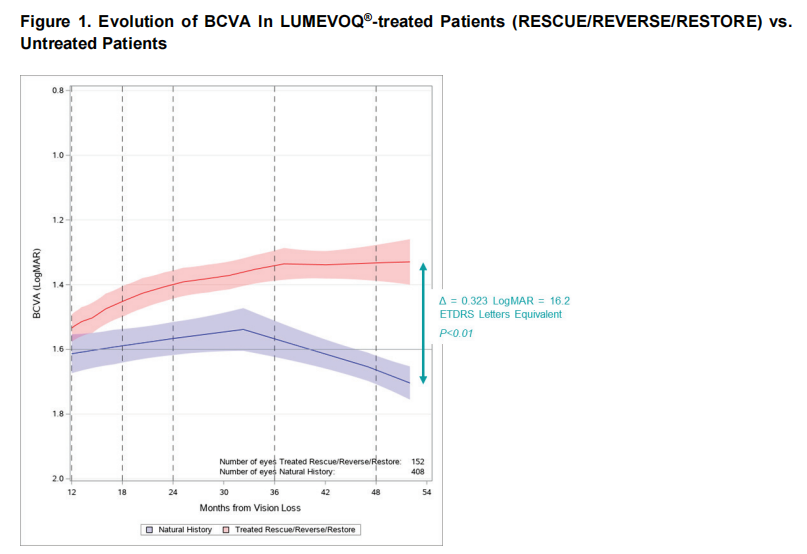
图:LUMEVOQ 治疗患者(RESCUE/REVERSE/RESTORE)与未治疗患者的BCVA演变
注射后4年的安全性结果与之前的读数一致,得出的结论是LUMEVOQ ®具有良好的耐受性:在LUMEVOQ ®治疗的眼睛中没有记录到严重的不良事件,也没有因眼部事件而停药。没有与研究治疗或研究程序相关的系统性严重不良事件或中止。
GenSight BiologicsSA是一家临床阶段的生物制药公司,专注于开发和商业化治疗视网膜神经退行性疾病和中枢神经系统疾病的创新基因疗法。GenSight Biologics的管道利用线粒体靶向序列(MTS)和光遗传学这两个核心技术平台来帮助保护或恢复患有致盲性视网膜疾病的患者的视力。
GenSightBiologics的主要候选产品LUMEVOQ已在欧洲提交上市批准,用于治疗Leber遗传性视神经病变(LHON),这是一种罕见的线粒体疾病,主要影响青少年和年轻人,导致不可逆转的失明。LHON的估计发病率在美国和欧盟每年大约有1,200-1,500名新患者失明。
GenSight Biologics的候选产品使用其基于基因治疗的方法,旨在通过玻璃体内注射对每只眼睛进行一次治疗,为患者提供可持续的功能性视力恢复。
参考资料:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












学习了
95