Radiology:深度学习在预测卵巢恶性肿瘤方面的性能
2022-08-25 shaosai MedSci原创
近年来,放射学界在机器学习的基础上开发了计算机辅助诊断工具。深度卷积神经网络可以通过非线性网络结构有效地学习特征,从而减少了网络参数的数量、缓解了过拟合现象。
据统计,卵巢癌是全世界范围内妇女癌症相关死亡的第二大原因,其5年生存率低于45%。卵巢肿瘤的早期发现和准确定性对病人的最佳治疗非常重要。良性肿瘤可以通过保守治疗,避免不必要的费用和过度治疗并保留生育能力。然而,恶性肿瘤需要转诊到妇科肿瘤科,进行适当的分期并考虑进行根治手术。为了提供个体化和有效的治疗方案,能够高度准确地区分良性和恶性卵巢肿瘤至关重要。
在筛查和识别卵巢肿瘤方面,US是一种方便且相对便宜的成像方式,通常是这些情况下的第一选择。专家对肿瘤的主观评估是对肿瘤进行分类的标准过程,但存在着显著的差异。因此,在美国放射学会的最新共识指南中引入了卵巢-附件报告和数据系统(O-RADS),为风险分层和管理提供一个标准参考。
近年来,放射学界在机器学习的基础上开发了计算机辅助诊断工具。深度卷积神经网络可以通过非线性网络结构有效地学习特征,从而减少了网络参数的数量、缓解了过拟合现象。到目前为止,为评估卵巢肿瘤而开发的深度学习(DL)算法很有限。
近日,发表在Radiology杂志的一项研究在灰度和彩色多普勒US图像上开发了一项自动分类卵巢肿瘤的DL算法,并将其诊断性能与O-RADS和专家主观评估进行了比较。

本项回顾性研究包括2019年1月-2019年11月期间接受灰度和彩色多普勒超声检查的连续女性卵巢肿瘤患者,其中组织病理学分析作为参考标准。数据集被分为训练(70%)、验证(10%)和测试(20%)集。开发了从ResNet修改的算法,有两种融合策略(特征融合[以下简称DLfeature]或决策融合[以下简称DLdecision])。在测试组中,通过AUC分析,将DL预测恶性肿瘤与O-RADS风险分类和专家评估进行了比较。
共有422名妇女(平均年龄46.4岁±14.8[SD])被纳入研究,其中有304个良性肿瘤和118个恶性肿瘤;在训练和验证数据集中有337名患者,在测试数据集中有85名患者。DLfeature对恶性和良性卵巢肿瘤分类的AUC为0.93(95% CI:0.85,0.97),与O-RADS(AUC,0.92;95% CI:0.85,0.97;P = .88)和专家评估(AUC,0.97;95% CI:0.91,0.99;P = .07)相当,并与DLdecision(AUC,0.90;95% CI:0.82,0.96;P = .29)相似。DLdecision、DLfeature、O-RADS和专家评估对恶性肿瘤的敏感度分别为92%、92%、92%和96%,特异度分别为80%、85%、89%和87%。
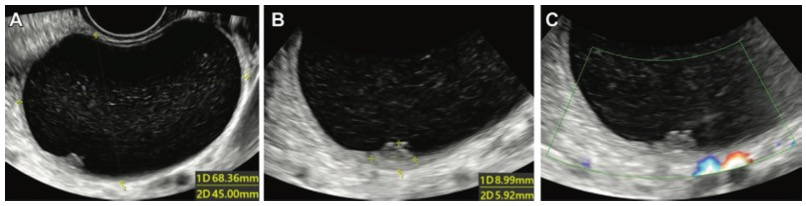
图 36岁女性,右卵巢囊肿伴实性成分。(A)灰度US图像显示肿块的最大尺寸平面,(B)灰度US图像显示实性成分的最大尺寸,以及(C)实性成分的彩色多普勒US图像(评分1)。病理诊断为浆液性囊腺纤维瘤。这是用卵巢附件报告和数据系统误诊的病例,而深度学习(DL)模型与决策融合、DL模型与特征融合以及专家评估都是正确的
本研究证明了基于多模态US图像的深度学习算法在预测卵巢恶性肿瘤方面的价值,其具有与专家主观和卵巢附件报告和数据系统评估相当的高诊断性能。
原文出处:
Hui Chen,Bo-Wen Yang,Le Qian,et al.Deep Learning Prediction of Ovarian Malignancy at US Compared with O-RADS and Expert Assessment.DOI:10.1148/radiol.211367
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#卵巢恶性肿瘤#
69