Nature Neuroscience:彭超团队揭示可溶性α-Syn的翻译后修饰可调控病理性 α-Syn 的传播过程的新机制
2023-01-29 朱若玮 “神经周K”公众号 发表于陕西省
该研究首次系统性地对从各种α-突触核蛋白病病患脑中纯化的可溶性 α-Syn 进行了 LC-MS/MS 分析,鉴定了大量的新型 α-Syn PTM,可作为后续关于可溶性α-Syn研究的宝贵资源。
以帕金森病、路易体痴呆(LBD)、多系统萎缩症 (MSA)和约50% 的阿尔茨海默病为代表的α-突触核蛋白病是一组以细胞内病理性α-突触核蛋白 (α-Syn) 积聚为特征的神经退行性疾病。越来越多的证据表明病理性α-Syn在细胞间的传播及随后的扩增是影响α-突触核蛋白病发病和进展的关键过程。多年来研究者们对于此过程的研究主要围绕于病理性α-Syn聚集体的释放、摄取、运输及降解,而作为底物的可溶性 α-Syn蛋白单体在此过程中的潜在作用被广泛地忽视。

2023年1月23日加州大学洛杉矶分校彭超课题组在Nature Neuroscience杂志上的发表题为 Post-translational modifications of soluble α-synuclein regulate the amplification of pathological α-synuclein的文章揭示了可溶性α-Syn的翻译后修饰 (PTM) 对于病理性 α-Syn 的传播过程依赖于位点和构想特异性的显着调节,并首次系统性地对从各种α-突触核蛋白病病患脑中纯化的可溶性 α-Syn 进行了 LC-MS/MS 分析,鉴定了大量的新型 α-Syn PTM,可作为后续关于可溶性α-Syn研究的宝贵资源。
为了探索可溶性α-Syn的磷酸化是否影响病理性α-Syn种子的扩增与传播,研究人员首先在患者脑样中证实了几个先前报道的 α-Syn 磷酸化位点的存在,将包括Y39和S87在内的位点突变为谷氨酸 (E) 以模拟人脑中不同的磷酸化 α-Syn并将其在HEK293细胞中进行表达,其次利用α-Syn 预制原纤维 (PFF), 从LBD患者大脑分离出的病理性 α-Syn (LB-α-Syn) 和从MSA 患者大脑分离出的病理性 GCI-α-Syn对细胞进行转导, 最后对在细胞中由不同条件诱导出的病理进行定量。实验结果表明,与 PFF相比,Y39 磷酸化显着阻断 LB-α-Syn的传播扩增,对于GCI-α-Syn的传播扩增能力也有些微抑制;S87 磷酸化略微提高了LB-α-Syn对于可溶性α-Syn 的播种,而对于GCI-α-Syn的传播扩增有显着的抑制作用。
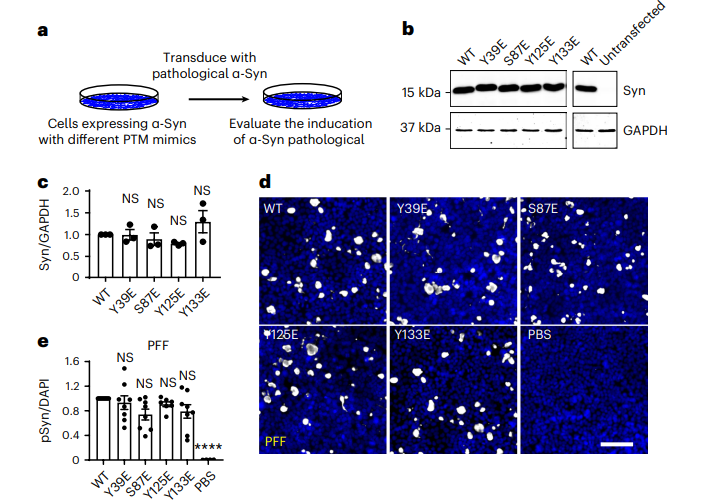
图1:Y39 磷酸化显着阻断 LB-α-Syn的传播扩增
为了真实模拟α-Syn的磷酸化,研究人员首先将合成的磷酸化Y39 和 S87 α-Syn 单体混合物用 LB-α-Syn、GCI-α-Syn 和 PFF在无细胞条件下进行播种,原纤维化后使用WB对原纤维中的pY39 和 pS87 α-Syn进行定量。此项实验证明相较于对磷酸化Y39 和 S87没有播种偏好的PFF, LB-α-Syn 优先播种 pS87 α-Syn 单体,而 GCI-α-Syn 优先播种 pY39 单体。其次,研究人员在HEK293 细胞中共表达WT α-Syn和被证实可以有效磷酸化α-Syn Y39的c-Abl,此项实验结果也进一步表明Y39位点的磷酸化可以降低LB-α-Syn和 GCI-α-Syn的播种能力但对 PFF没有明显影响。
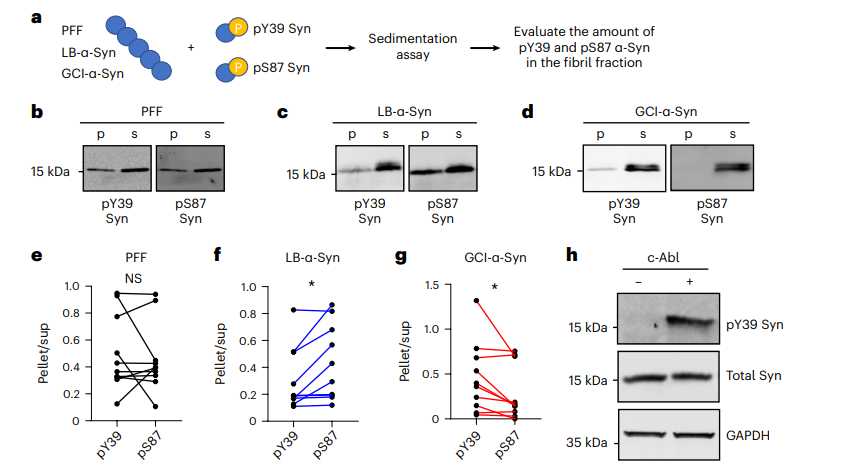
图2:可溶性α-Syn磷酸化可调节GCI-α-Syn和LB-α-Syn的扩增
与此同时,研究人员利用腺相关病毒 (AAV) 在大鼠原代神经元中表达WT α-Syn或 S87E 突变体,并在原代神经元中重现了S87磷酸化位点对于LB -α-Syn传播能力的提高作用和对GCI-α-Syn种子传播能力的显着降低作用。由此,实验结果表明可溶性 α-Syn 的磷酸化会影响病理性 α-Syn 的播种能力,并且这种影响依赖于构象和磷酸化位点。
由于此前对于可溶性α-Syn PTM的研究有限,研究人员通过免疫沉淀(IP) 从各种患有 α-突触核蛋白病的患者大脑和正常大脑中纯化了可溶性 α-Syn 样品,随后通过LC-MS/MS对其进行分析。在鉴定出的51种PTM修饰种,有44种是尚未被报道的修饰。鉴于在可溶性 α-Syn 上发现了大量新的乙酰化位点,研究人员进一步采用从赖氨酸 (K) 到谷氨酰胺 (Q) 突变体来模拟赖氨酸乙酰化,并在细胞中的探究可溶性 α-Syn 的乙酰化对于病理性 α-Syn 的传播能力的调节。 结果同样表明可溶性 α-Syn 的乙酰化也可以位点和构象依赖性的方式调节病理性 α-Syn 的扩增。
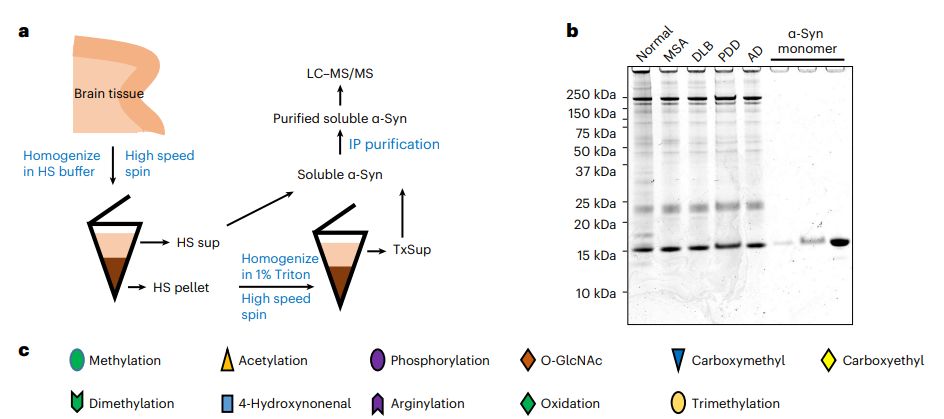
图3:可溶性 α-Syn 上存在大量新的乙酰化位点
最后,研究人员进一步探究可溶性 α-Syn 上的 PTM 是否也可以调节病理性 α-Syn 的播种特性。通过将α-Syn PFF 和 GCI-α-Syn 在表达各种 α-Syn 磷酸化模拟突变体的 HEK293 细胞中传代,随后将传代后的α-Syn PFF 和GCI-α-Syn对原代神经元进行转导以衡量其传播能力。 结果表明Y39 和 S87 磷酸化突变体显着降低了 GCI-α-Syn 的播种能力,而对α-Syn PFF的播种能力没有明显影响。然而,在经过连续的两轮传代后,Y39 和 S87 磷酸化突变体对于GCI-α-Syn 的播种能力有了进一步的抑制。 由此研究人员推断,可溶性 α-Syn PTM 不仅可以影响病理性 α-Syn 的扩增,还可以影响病理性 α-Syn 扩增后的播种特性。
本文揭示了可溶性 α-Syn PTM对于调节病理性 α-Syn传播与扩增过程的新机制。此机制可以扩展到对于其他神经退行性疾病的研究。本文从病患脑样中鉴定出的大量新型可溶性α-Syn PTM也被作为科学家进行后续研究的宝贵资源。
原始出处:
Zhang, S., Zhu, R., Pan, B. et al. Post-translational modifications of soluble α-synuclein regulate the amplification of pathological α-synuclein. Nat Neurosci (2023). https://doi.org/10.1038/s41593-022-01239-7.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







签到学习
0