FDA:2011财政年度批准的创新性新药
2011-11-17 MedSci原创 MedSci原创
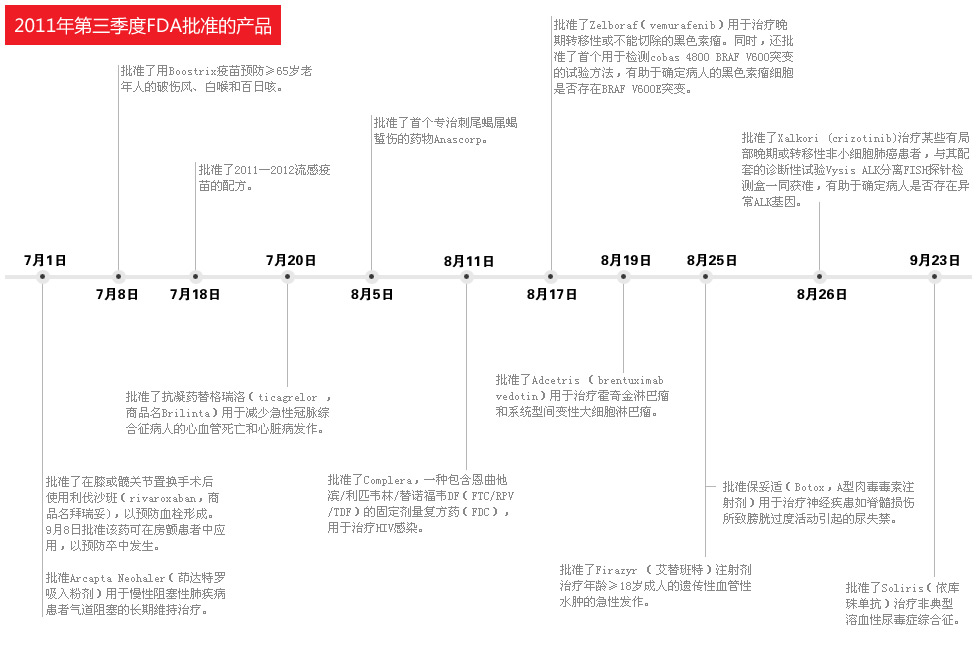
报告显示,美国在快速批准药物安全性及有效性方面位于世界领先水平。 在过去的一年中,美国食品药物管理局批准了35个新药,是在过去十年内仅次于2009年(37个)的批准数量。 报告显示美国快速批准安全和有效药物走在其它各国之前。 美国食品药品监督管理局在过去的12个月内批准了35个新药。这是在过去十年内批准的最高数目,仅低于2009年(37个)。许多药物都对患者的治疗有重要进展,包括两个丙肝
报告显示,美国在快速批准药物安全性及有效性方面位于世界领先水平。
在过去的一年中,美国食品药物管理局批准了35个新药,是在过去十年内仅次于2009年(37个)的批准数量。
报告显示美国快速批准安全和有效药物走在其它各国之前。
美国食品药品监督管理局在过去的12个月内批准了35个新药。这是在过去十年内批准的最高数目,仅低于2009年(37个)。许多药物都对患者的治疗有重要进展,包括两个丙肝治疗新药、一个晚期前列腺癌药物、30年内首个霍金氏淋巴瘤新药以及50年内首个红斑狼疮新药。
2011年11月3日FDA发布题为《2011财政年度批准的创新性新药》的报告(FY 2011 Innovative Drug Approvals),文中FDA提供了其在处方药使用者费用法案(Prescription Drug User Fee Act PDUFA)下如何使用使用加快批准,灵活的临床数据需求和资源采集,截至财政年度结束的2011年9月30日,共批准了35个创新性药物。这些在药物安全标准可保持的情况下获得批准。
报告显示,美国FDA较全球其他机构能更快的批准药物,35个药品中有24种早于其他国家及欧盟等地区获得批准。美国继续保持世界批准新药的领先趋势。
行政长官Margaret Hamburg表示:一年能批准35个重要的药物显示出制药业及FDA的良好业绩,我们将继续利用可以利用的资源为患者寻求新的治疗方案,将继续致力于与制药业合作,推进科学及创新以创造产生突破性治疗,确保美国能完全解决21世纪公共卫生所面临的挑战。
2011财政年度中批准的新药中,一些品种对病人治疗及批准效率值得瞩目:
(1)两个药物——一个用于黑色素瘤,另一个用于肺癌——是个性化治疗的突破。批准时同时批准诊断试纸,帮助识别鉴定药物很可能带来效益的患者;
(2)7个新药提供了癌症治疗的重要进展;
(3)几乎半数药物对心脏病、卒中或肾移植排斥显着的治疗进展;
(4)十种药是为罕见或“孤儿”病,患者较少治疗方案也非常少,如遗传性血管水肿的治疗。
(5)几乎半数(16种)是通过“优先审查,”而获得批准的,FDA仅用6个月即完成安全性和有效性审查。
(6)三分之二新批准是在单次审查周期内完成,意味着制造商提供证据非常充分,所以无需向FDA提交更全面的资料就可从审查过程转向申请过程;
(7)三种药物利用“加速批准”批准,即FDA快速批准医疗上安全和有效重要新药并以上市后临床证实其效益。例如,Corifact,首个某罕见血液凝固疾病治疗新药,即是在此程序下获得批准的;
(8)34个药物是与在药企同意下按照PDUFA在目标审查时间内获得批准的,其中有3个癌症药物是FDA少于6个月的时间批准。
1992年美国国会制定处方药用户收费法[Prescription Drug User Fee Act]以保证FDA掌握足够的资源,为新药的安全和及时审查并为增加药物安全性努力。PDUFA当前的立法授权,2012年9月30日到期。
FDA药品评价及研究中心负责人Janet Woodcock, 博士表示:“PDUFA法案实施前,美国患者通常都在长期等待后才在其他地方获得新药,由于该法案,美国患者在快速得到新药同时可高标准的保持安全性和有效性。”
2011年10月,发布一个新计划,即,推动生物医药创新:创新性改进患者的产品(Driving Biomedical Innovation: Initiatives to Improve Products for Patients),协助从事新产品开发,特别是规模较小,创业公司的公司。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









Thank God! Someone with brains spkeas!
154
#创新#
0