中性粒细胞介导的羟氯喹和紫杉醇共载脂质体对术后三阴性乳腺癌复发和转移的影响
2023-01-26 August MedSci原创 发表于上海
切除术后的复发和转移仍然是乳腺癌临床治疗的主要挑战。残留的肿瘤和癌症干细胞样细胞是复发和转移的罪魁祸首。
根据2020年全球癌症统计数据,乳腺癌在全球各种癌症类型中排名第一。缺乏PR、ER和人表皮生长因子受体2型的肿瘤被定义为TNBC。与其他亚型相比,TNBC富含癌症干细胞(CSC),导致临床预后不良。手术是原发性乳腺癌的一线治疗之一。然而,一些微肿瘤可能仍然存在于手术腔中。由于术后炎症和CSCs的存在,残留的癌细胞倾向于逃避免疫监视并再生,导致术后复发和远处转移。因此,迫切需要制定更有效的术后治疗实用策略。
大量证据表明,自噬可能是控制肿瘤向干细胞样细胞分化的参与者。自噬是一种基本的细胞降解机制,可以维持细胞稳态并促进细胞存活。在肿瘤细胞中,自噬可以提供营养以维持CSCs的存活以及调节肿瘤迁移和侵袭。该过程的调节涉及多种分子机制。HCQ是一种广泛使用的自噬抑制剂,可抑制自噬体与溶酶体的融合。在之前的研究中,证明了HCQ和化疗的协同联合治疗具有显着的抗肿瘤和抗转移作用。
此外,术后肿瘤靶向药物递送仍然是一个棘手的问题。大多数传统纳米颗粒依赖于完整实体瘤的增强通透性和保留(EPR)效应。幸运的是,近年来仿生给药系统的出现为术后治疗提供了机会。特别是,基于中性粒细胞的细胞载体可以对手术产生的炎症环境做出反应,并沿着炎症因子梯度主动迁移到手术部位。因此,它可以克服传统纳米药物的困境,即EPR效应依赖性。基于中性粒细胞的细胞载体是非免疫原性的,可避免网状内皮系统的清除。中性粒细胞还具有强大的吞噬能力,使它们能够内化和承受药物负担。因此,基于中性粒细胞的细胞载体是一种很有前途的术后肿瘤靶向载体。需要注意的是,现有的仿生携带者大多使用单一药物,采用传统的化疗或放疗。耐药细胞和CSC很容易在传统治疗中存活,导致术后复发。因此,新的联合策略可能是预防术后复发和转移的关键。
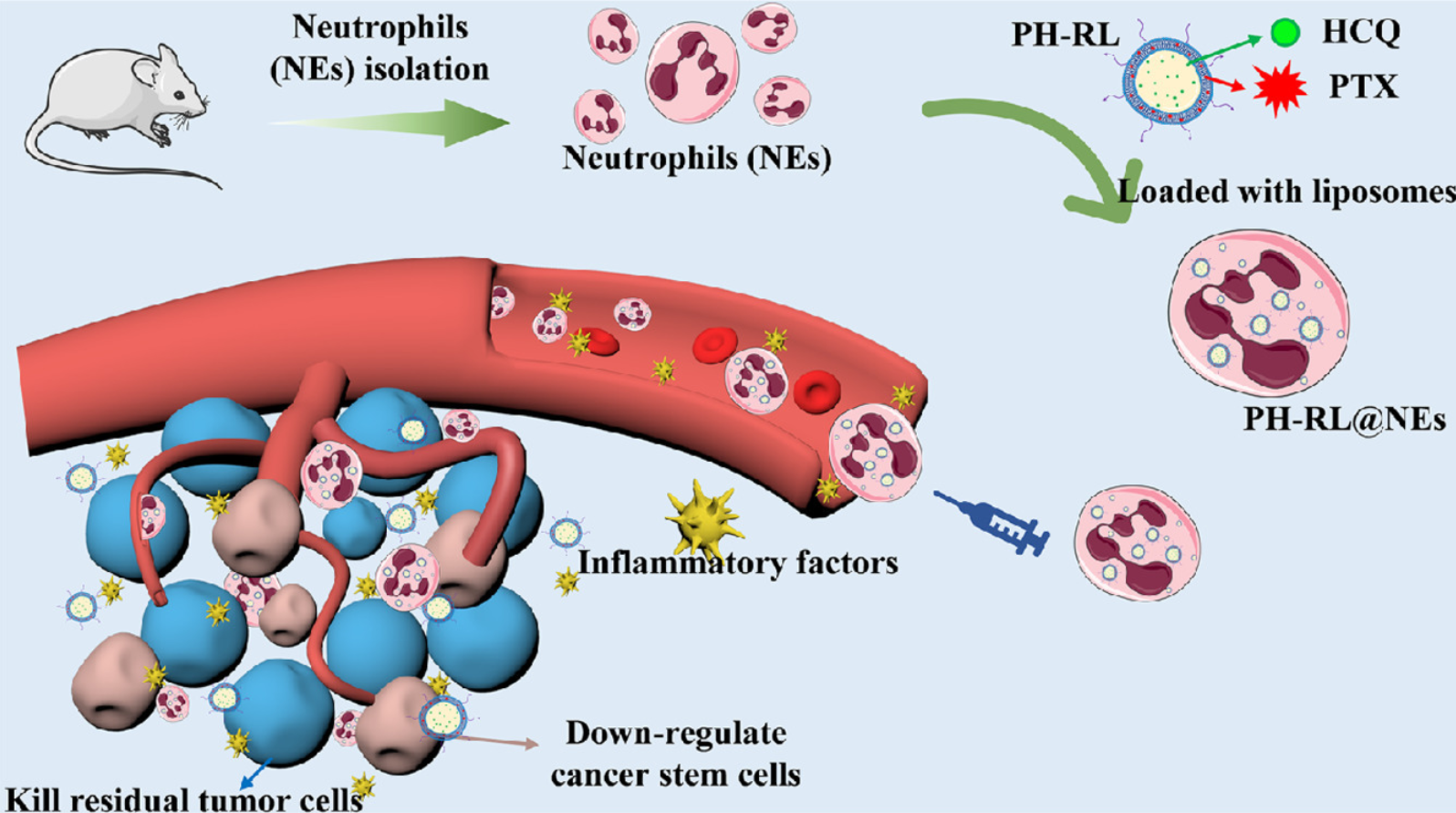
在这里,研究者设想了一种“特洛伊木马”策略来构建与PTX和HCQ共载的中性粒细胞介导的脂质体(PH-RL@NEs)。中性粒细胞载体由炎症因子驱动,炎症因子充当特洛伊木马,在手术后准确到达残留肿瘤,从而提高给药药物的治疗效率。受肿瘤部位炎症刺激,“特洛伊木马”打开并释放“勇士”,即载药脂质体PH-RL。目的是评估抑制自噬作为一种辅助治疗是否可以通过阻断EMT和干细胞形成来预防乳腺癌症术后复发和转移。
中性粒细胞作为“特洛伊木马”,可以快速反应术后炎症,将药物准确输送到残留肿瘤部位。然后打开炎症触发的“特洛伊木马”以释放含有化疗药物紫杉醇(PTX)和自噬抑制剂羟氯喹(HCQ)的脂质体。研究者发现HCQ可以有效抑制肿瘤细胞自噬,干扰肿瘤上皮-间充质转化,减少肿瘤干细胞样群体。在原位4T1术后复发模型中,PTX和HCQ协同杀死肿瘤,调节肿瘤细胞的干性,从而显著抑制肿瘤复发和转移。其工作证明了,抑制自噬降低肿瘤干性是可行和有效的,为术后肿瘤治疗开辟了新的前景。
总之,研究通过抑制自噬来调节肿瘤细胞的干性,从而抑制乳腺癌细胞的术后复发和转移。结果表明,PH-RL@NEs借助中性粒细胞术后炎症趋化性,提高了靶向药物递送效率。HCQ有效抑制肿瘤细胞自噬,还原肿瘤干细胞样细胞,从而提高4T1原位术后复发模型的治疗效果。
参考文献:Ren K, He J, Qiu Y, et al. A neutrophil-mediated carrier regulates tumor stemness by inhibiting autophagy to prevent postoperative triple-negative breast cancer recurrence and metastasis. Acta Biomater. 2022;145:185-199. doi:10.1016/j.actbio.2022.04.017
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










自噬可能是控制肿瘤向干细胞样细胞分化的参与者。自噬是一种基本的细胞降解机制,可以维持细胞稳态并促进细胞存活。
59