维莫司和羟氯喹在既往治疗过的肾细胞癌患者中的I/II期试验
2023-01-24 August MedSci原创 发表于上海
依维莫司抑制mTOR,激活细胞保护性自噬。羟氯喹抑制自噬。根据临床前数据证明mTOR抑制剂与自噬抑制剂联合使用时具有协同细胞毒性。
依维莫司抑制mTOR,阻断生长因子信号传导的关键下游效应物。抑制mTOR导致蛋白质翻译(包括关键的葡萄糖和氨基酸转运蛋白)迅速下降,导致细胞外营养摄取的消除。因此,通过抑制mTOR,依维莫司是癌细胞代谢应激的有效启动剂。
自噬是一种细胞内过程,其特征在于形成自噬囊泡,其螯合细胞质内容物并将其靶向以在溶酶体中降解。这个过程被代谢压力激活,也由大多数癌症疗法。癌细胞使用自噬来去除受损的细胞器并回收大分子,这些大分子在面对营养缺乏危机时充当内部燃料库。抑制mTOR是自噬最有效的诱导剂之一。自噬的治疗性激活可能是依维莫司对mTOR抑制的关键耐药机制。最初的体内研究表明,用氯喹衍生物抑制治疗诱导的自噬可增强小鼠淋巴瘤模型中的细胞死亡和肿瘤消退。此外,在多种癌症类型中,与单独使用每种药物相比,靶向mTOR信号传导的药物与羟氯喹联合使用可增强细胞死亡。当雷帕霉素类似物替西罗莫司与羟氯喹在肾细胞癌(RCC)细胞系和RCC的原位小鼠模型中联合使用时观察到协同细胞死亡。此外,研究者证明了替西罗莫司和羟氯喹联合用于实体瘤患者的安全性和初步活性。在该 Ib 期研究中,FDA 批准的最高剂量羟氯喹 600 mg,口服,每日两次,与替西罗莫司安全联合使用。研究者假设结合mTOR和自噬抑制在ccRCC等疾病中最为有效,其中mTOR抑制剂依维莫司具有单药活性。基于这一假设,研究者进行了一项依维莫司联合羟氯喹治疗晚期透明细胞RCC(ccRCC)患者的多机构开放标记I / II期试验。
患者及方法:三个中心在晚期ccRCC患者中进行了依维莫司每日10mg和羟氯喹的I/II期试验。目的是确定羟氯喹联合每日依维莫司的MTD,并估计接受依维莫司/羟氯喹治疗的ccRCC患者在1-3次先前治疗方案后的6个月无进展生存率(PFS)。确定获益最大的患者亚群的相关研究包括群体药代动力学、通过电子显微镜测量自噬体和下一代肿瘤测序。
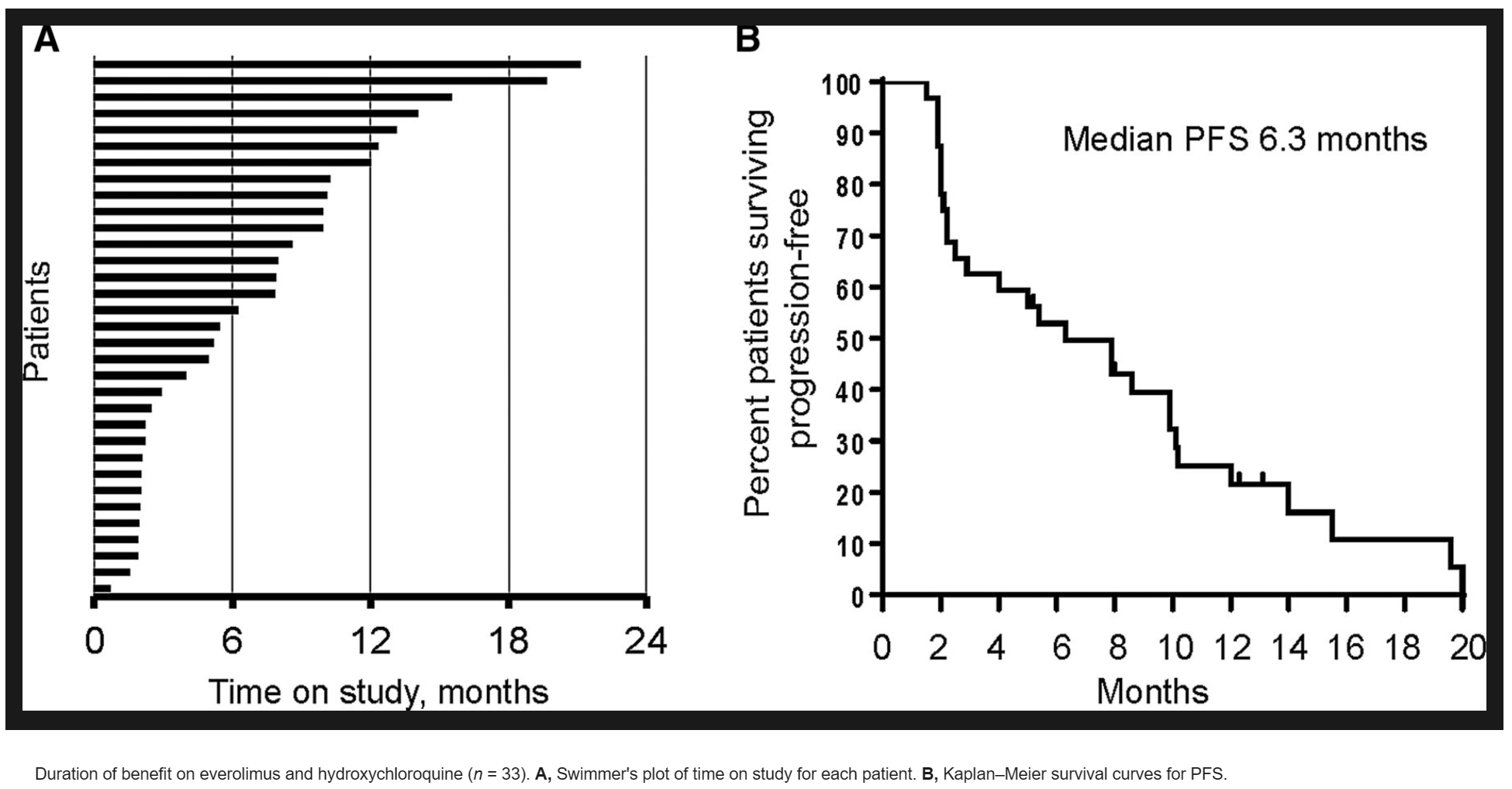
结果:在I期试验中未观察到剂量限制性毒性。确定了推荐的羟氯喹600mg每日两次与依维莫司的II期剂量。疾病控制[疾病稳定+部分缓解(PR)]发生在33名可评估患者中的22名(67%)。33例患者中有2例(6%)观察到PR。在33名达到疾病控制的患者中,有15名(45%)实现了6个月的PF≥S。
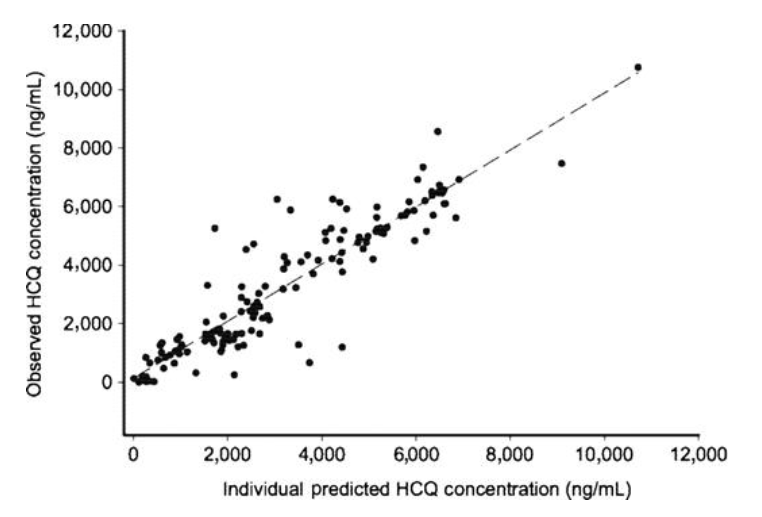
依维莫司和羟氯喹的组合耐受性良好,仅观察到依维莫司相关的毒性。在这项I/II期研究中,3-4级AE率为<10%。羟氯喹群体药代动力学参数与先前报道的接受口服羟氯喹的晚期癌症患者的分析相当,其中羟氯喹药代动力学存在较大的患者间差异。羟氯喹广泛分布在身体组织中,这反映在其大表观分布体积上,特别是外周隔室。羟氯喹具有较长的半衰期,这可以归因于广泛分布到组织中并分配到红细胞中。由于羟氯喹不与血浆蛋白广泛结合,因此蛋白质结合的改变不太可能影响其处置。
总之,联合羟氯喹600mg每日两次,依维莫司10mg每日是可以耐受的。达到>40%6个月PFS率的主要终点。羟氯喹是未来RCC或其他试验中可耐受的自噬抑制剂。
参考文献:Haas NB, Appleman LJ, Stein M, et al. Autophagy Inhibition to Augment mTOR Inhibition: a Phase I/II Trial of Everolimus and Hydroxychloroquine in Patients with Previously Treated Renal Cell Carcinoma. Clin Cancer Res. 2019;25(7):2080-2087. doi:10.1158/1078-0432.CCR-18-2204
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言