南京大学医学院附属鼓楼医院张峰Nano Letter:“衰老抗肝纤维化”,用魔法打败魔法
2024-01-07 BioMed科技 BioMed科技 发表于陕西省
近期,南京大学医学院附属鼓楼医院消化内科张峰副教授等人阐释了通过激活cGAS-STING通路诱导活化HSCs衰老,同时增强NK细胞的免疫功能清除衰老细胞,是一种有前景肝纤维化治疗策略。
肝纤维化是各种慢性肝病进展为肝硬化的必经阶段。据估计,全世界每年有200万人死于慢性肝病。活化的肝星状细胞(hepatic stellate cells,HSCs)在肝纤维化中发挥重要作用,是细胞外基质(extracellular matrix,ECM)的主要来源。抑制活化HSCs增殖或诱导其凋亡是目前研究较多的灭活HSCs的策略,但临床上至今仍无有效的抗肝纤维化药物。诱导活化HSCs衰老能够通过阻止HSCs分裂,减少ECM的产生,从而逆转肝纤维化。然而,由于损伤因素持续存在或免疫清除机制失效,衰老的HSCs也可能在慢性肝病中积累,分泌衰老相关分泌表型(senescent associated secretory phenotype,SASP)因子,形成低度的慢性炎症微环境,加重纤维化和器官功能障碍。因此,诱导活化HSCs衰老并及时清除衰老细胞才是有效的抗纤维化策略。
环鸟苷单磷酸腺苷合酶(cyclic guanosine monophosphate-adenosine monophosphate synthase,cGAS)-干扰素基因刺激因子(stimulator of interferon genes,STING)通路对衰老和SASP的调控至关重要。该通路的激活还可以刺激I型干扰素反应产生强大的先天免疫反应。SASP的一个关键作用是招募免疫细胞清除衰老细胞和维持组织稳态。近期,南京大学医学院附属鼓楼医院消化内科张峰副教授等人阐释了通过激活cGAS-STING通路诱导活化HSCs衰老,同时增强NK细胞的免疫功能清除衰老细胞,是一种有前景肝纤维化治疗策略。
该研究构建了白蛋白锰纳米粒(Mn@ALB NPs),利用白蛋白能够优先被肝窦内皮细胞(liver sinusoidal endothelial cells,LSECs)摄取及其在LSECs中的转胞吞运输作用,使得Mn@ALB NPs跨越内皮细胞屏障抵达Disse间隙。此外,活化HSCs高表达的SPARC(secreted protein acidic and cysteine rich)是一种经典的白蛋白结合蛋白,这种蛋白肝细胞几乎不表达,使得Mn@ALB NPs能够精准靶向活化HSCs,随后诱导活化HSCs衰老并增强NK细胞免疫清除衰老细胞,展现出有效的抗纤维化甚至逆转纤维化作用。相关工作以“Senescence of Hepatic Stellate Cells by Specific Delivery of Manganese for Limiting Liver Fibrosis”为题发表在NANO LETTERS。
【文章要点】
在这项研究中,作者首先确认具有cGAS-STING激动作用的Mn2+对活化HSCs的衰老调控的干预效应。通过对MnCl2处理后的人源活化肝星状细胞LX-2的衰老相关表型以及SASP因子的表征,证明MnCl2能够通过激活cGAS-STING通路诱导LX-2衰老和SASP分泌(图1)。
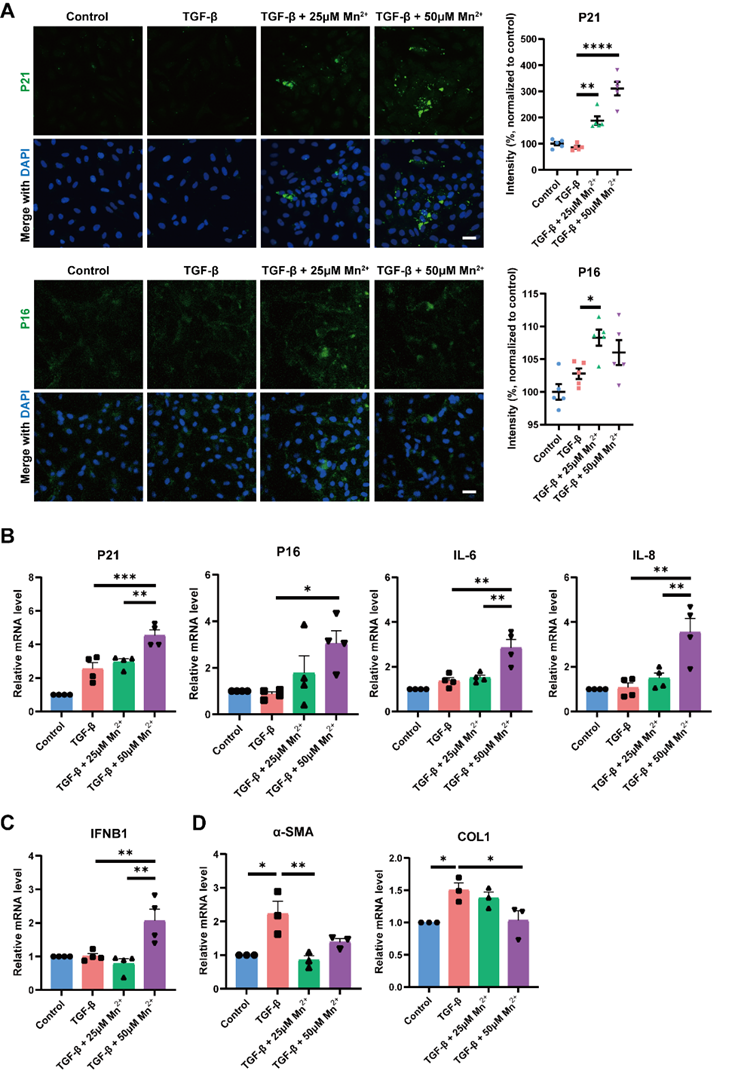
图1. Mn2+诱导TGF-β诱导的LX-2细胞衰老
随后,通过将MnCl2处理后的LX-2与NK-92细胞(人源NK细胞)共培养,证明NK细胞对MnCl2处理后的衰老LX-2的杀伤毒性增强(图2)。
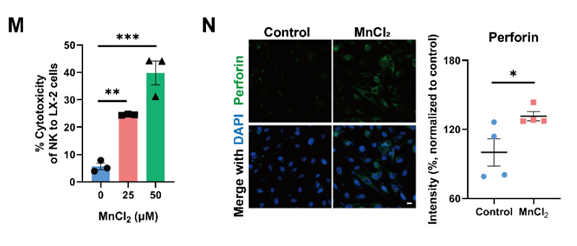
图2. NK细胞对MnCl2处理后的衰老LX-2的杀伤毒性增强
更进一步,在快速诱导活化HSCs积累的急性肝损伤小鼠模型中初步验证了Mn2+对活化HSCs的衰老调控的干预效应。实验结果表明MnCl2处理在体内诱导了活化HSCs衰老并增强了NK细胞的杀伤能力,减少了活化HSCs,抑制小鼠肝脏的早期纤维形成(图3)。
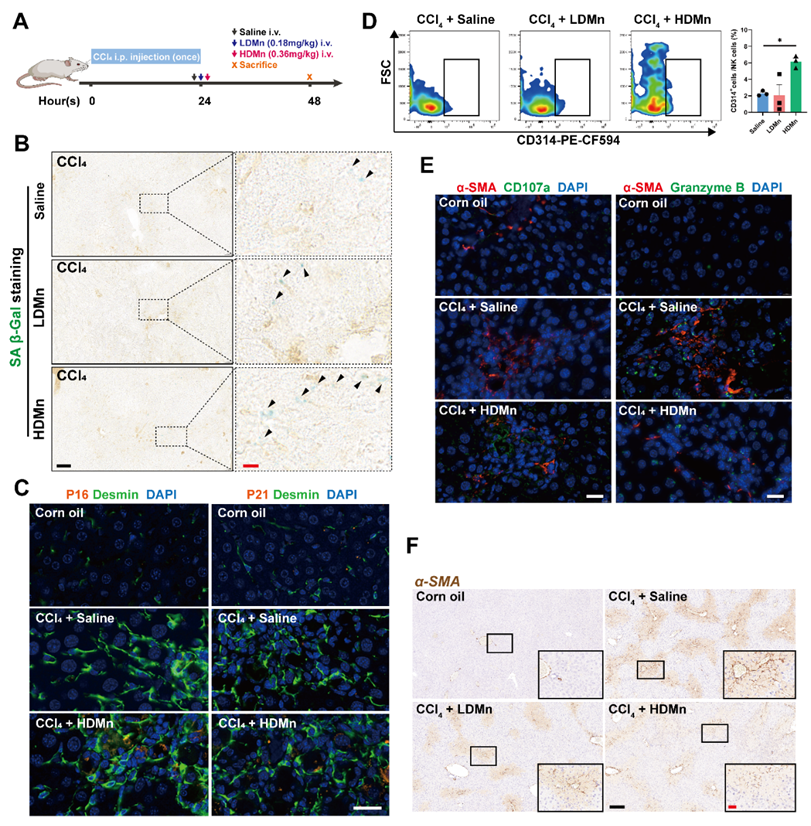
图3. Mn2+诱导急性肝损伤小鼠活化HSCs衰老,限制早期纤维化
考虑到MnCl2在体内极易代谢清除,且长期用药存在一定的神经毒性,作者通过纳米递送体系来特异性递送Mn2+以靶向活化HSCs。然而HSCs仅在肝细胞总数中占比不到10%,且位于LSECs与肝细胞之间的Disse间隙内,这一难以到达的自然解剖位置和纤维化肝脏中LSECs去窗孔化导致的物质交换减少阻碍了药物的靶向递送,降低了疗效。因此,在肝纤维化中,物质从肝血窦抵达Disse间隙的途径可能是通过LSECs的转胞吞作用。鉴于白蛋白是参与转胞吞运输的重要载体分子之一,该研究构建了白蛋白锰纳米粒(Mn@ALB NPs),利用白蛋白能够优先被LSECs摄取及其在LSECs中的转胞吞运输作用,使得Mn@ALB NPs跨越内皮细胞抵达Disse间隙。此外,活化HSCs高表达的SPARC是一种经典的白蛋白结合蛋白,这种蛋白肝细胞几乎不表达,使得Mn@ALB NPs能够精准靶向活化HSCs。体外实验证实Mn@ALB NPs能够通过转胞吞运输穿过内皮细胞随后递送至活化HSCs,在不影响肝细胞的情况下诱导活化HSCs衰老(图4)。
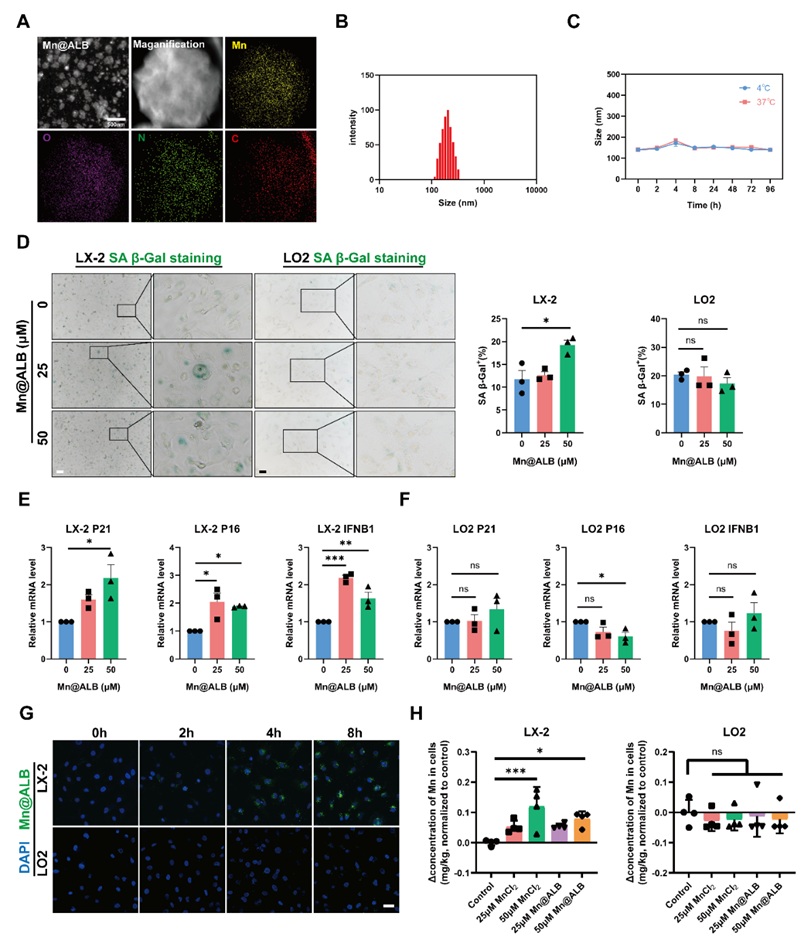
图4. Mn@ALB NPs特异性地诱导活化HSCs而非肝细胞衰老
鉴于目前批准的基于纳米技术的产品只有白蛋白制剂和脂质体,该研究进一步制备脂质体锰纳米粒(Mn@Lipo NPs)进行对比,结果表明只有Mn@ALB NPs具备转胞吞跨越内皮细胞的能力,再通过小动物近红外荧光成像、小动物核磁共振成像、荧光标记后的组织切片以及ICP-MS等实验,证明Mn@ALB NPs能够蓄积到肝组织并靶向活化HSCs,同时降低Mn2+的脑内蓄积(图5)。最后利用慢性肝纤维化小鼠模型证明Mn@ALB NPs能够跨越内皮细胞进入Disse间隙并被活化HSCs特异性摄取,随后诱导HSCs衰老并被NK细胞免疫清除,展现出有效的抗纤维化甚至逆转纤维化作用(图6)。
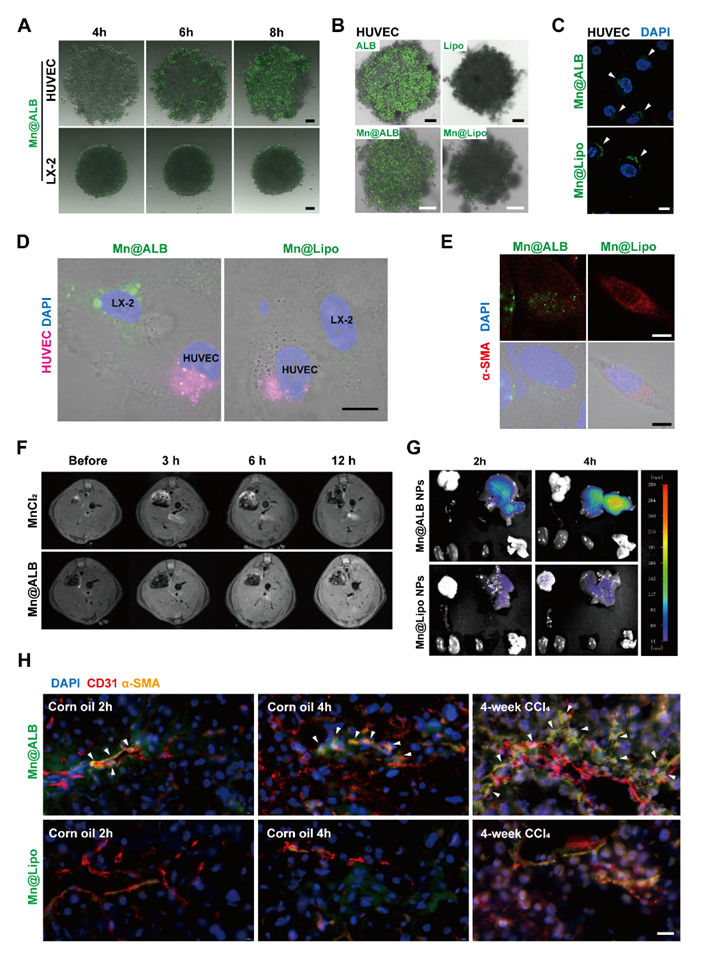
图5. 通过转胞吞作用将Mn@ALB NPs特异性递送至活化的HSCs
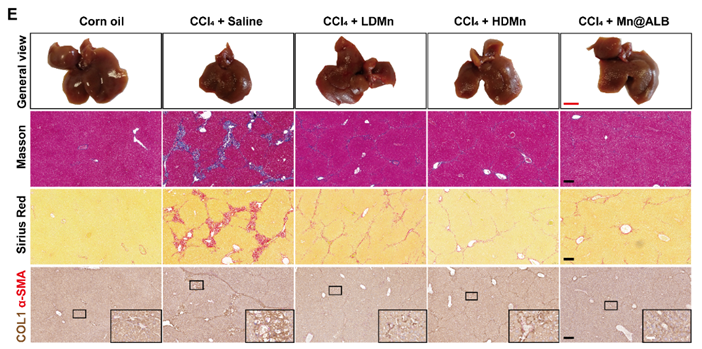
图6. Mn@ALB NPs在CCl4诱导的慢性肝纤维化小鼠模型中抑制肝纤维化
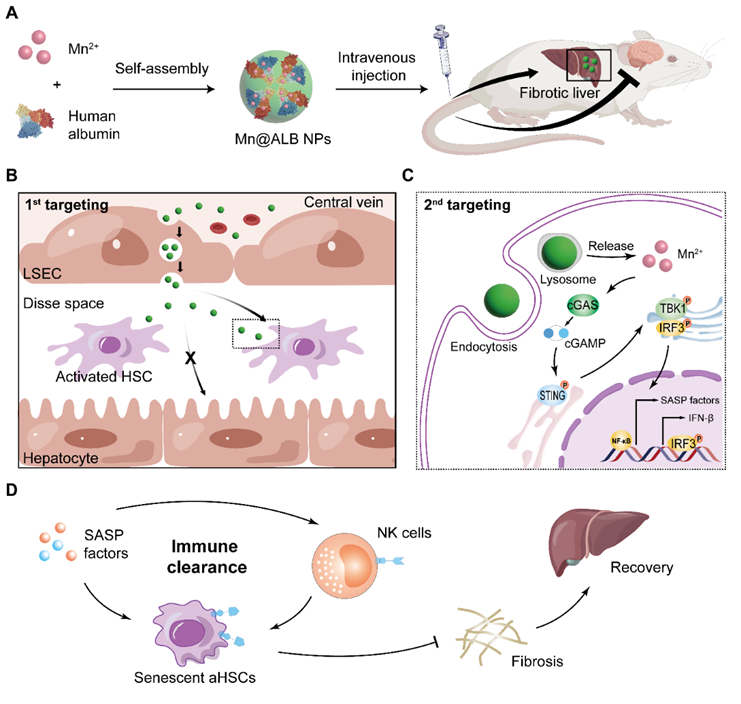
图7. 通过白蛋白介导转胞吞作用特异性递送锰诱导HSCs衰老以限制肝纤维化的模式图
综上,该研究针对慢性肝纤维化中活化HSCs难以靶向清除的关键科学问题,验证了通过白蛋白介导的转胞吞运输特异性递送Mn2+以诱导活化HSCs衰老从而限制肝纤维化策略的可行性。该文证明了Mn2+能够通过激活cGAS-STING通路诱导活化HSCs衰老,同时增强NK细胞免疫清除衰老细胞以抑制甚至逆转肝纤维化。同时,基于白蛋白转胞吞运输跨越内皮细胞特异性递送锰的纳米递送体系能够靶向活化HSCs,同时降低Mn2+的神经毒性,在减少毒副作用的同时发挥强大的抗纤维化作用(图7)。该研究为临床抗纤维化药物的研发提供了新的思路。
南京大学医学院附属鼓楼医院消化内科张峰副教授、诸葛宇征教授和南京大学医学院吴锦慧教授为该论文的共同通讯作者。南京大学医学院顾丽红、赵宸萱博士、王宜萱硕士为该论文的共同第一作者。该研究受到国家自然科学基金、国家科学技术部、南京市卫健委医学科技发展基金重点项目等项目资助。
原文链接:
https://doi.org/10.1021/acs.nanolett.3c03689
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#肝纤维化# #cGAS-STING#
113