Advanced Materials:国家纳米中心王海团队在肿瘤纳米疫苗中取得新突破
2022-11-23 网络 网络
该研究构建了一种高效、可直接呈递主要组织相容性复合体(MHC)-肿瘤抗原给T细胞的纳米树突状细胞疫苗。
肿瘤疫苗是指利用肿瘤抗原,通过主动免疫方式诱导机体产生特异性抗肿瘤效应,激发机体自身的免疫保护机制,达到治疗肿瘤或预防肿瘤发生的作用。尽管基于疫苗的抗肿瘤疗法有优越的理论基础,但目前未能达到令人满意的临床治疗效果。其中,提高疫苗的免疫刺激效率是肿瘤免疫治疗领域的重要研究方向之一。
2022年10月11日,中国科学院国家纳米科学中心王海研究团队在 Advanced Materials 期刊发表了题为:Direct Presentation of Tumor-Associated Antigens to Induce Adaptive Immunity by Personalized Dendritic Cell-Mimicking Nanovaccines 的研究论文。
该研究构建了一种高效、可直接呈递主要组织相容性复合体(MHC)-肿瘤抗原给T细胞的纳米树突状细胞疫苗。

该研究通过体外控制刺激条件的方式,将小鼠体内提取并诱导出的骨髓来源树突状细胞(BMDCs)和肿瘤细胞-细菌融合材料共孵育,以此得到包含MHC-肿瘤抗原复合物的个性化树突状细胞疫苗。研究将提取包含有个性化MHC-肿瘤抗原复合体和共刺激因子(CD80/86)的细胞膜包覆在叶酸-铁离子自组装的树突状纳米颗粒上,以此构建得到可直接刺激T细胞诱导特异性肿瘤免疫反应的纳米树突状细胞疫苗。
实验结果表明,该纳米树突状细胞呈现显著淋巴结归巢能力和诱导特异性细胞免疫效果,在体内有效抑制了肿瘤生长和转移灶形成,且诱导了记忆T细胞的长期免疫保护,有望用于个性化肿瘤免疫治疗。
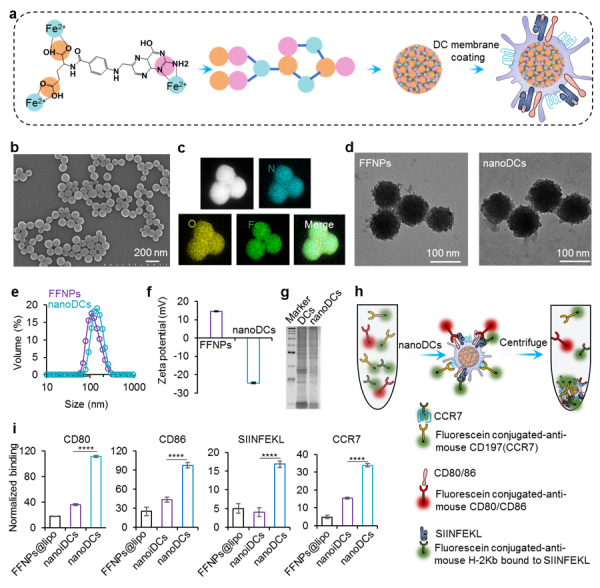
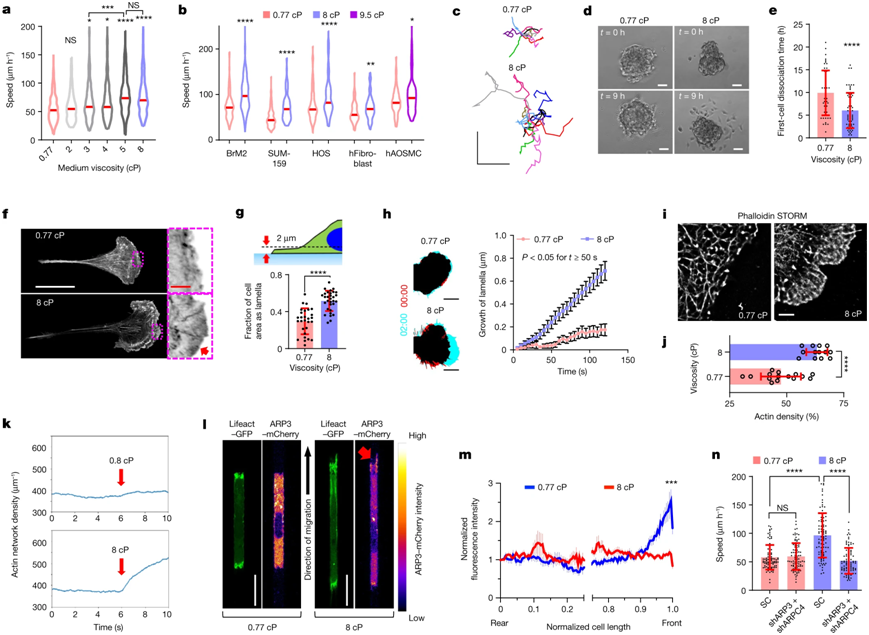
a、合成纳米DC疫苗示意图;b-d、SEM和TEM表征树枝状纳米颗粒;e-f、纳米颗粒粒径分布和电荷表征;g-i、蛋白质电荷和pull-down试验验证纳米DC疫苗携带相关疫苗递呈蛋白复合体。
mRNA技术可通过人体细胞的蛋白质合成系统合成出特异性的肿瘤抗原,以诱导免疫反应从而特异性的攻击肿瘤细胞,因此,mRNA肿瘤疫苗成为个性化免疫治疗的另一重要策略。
脂质纳米颗粒(LNPs)作为非病毒递送载体将mRNA递送至胞质,而目前mRNA-LNPs疫苗的超低温储存和运输阻碍了其临床应用。
2022年11月11日,王海研究团队在 Advanced Functional Materials 期刊发表了题为:Stabilizing RNA Nanovaccines with Transformable Hyaluronan Dynamic Hydrogel for Durable Cancer Immunotherapy 的研究论文。
该研究开发了一种水凝胶-LNPs系统(HA-mRLNPs),可以有效地将编码肿瘤抗原的mRNA递送到树突状细胞进行抗原呈递,诱导抗原特异性CD8+T细胞杀伤肿瘤细胞。而且可在室温下储存。该研究证明稳定和持久免疫水凝胶-LNPs体系可用于有效的肿瘤免疫治疗。

为了提高mRNA-LNPs疫苗的热稳定性和对免疫系统刺激的持久性,研究团队采用一种可变形的水凝胶-LNPs系统(HA-mRLNPs),可在室温下存储mRNA疫苗,用于体内持久免疫治疗。该研究通过构建高混合效率的微流控芯片实现封装编码肿瘤抗原mRNA和免疫佐剂的新型LNPs,随后通过动态透明质酸水凝胶限制LNPs的迁移和融合以提高mRNA疫苗在室温下的储存时间。
此外,透明质酸链在生理条件下是可移动的,不能永久保持凝胶状状态,从而可控的释放mRNA纳米疫苗,并递送至树突状细胞,进而诱导抗原特异性T细胞杀伤肿瘤细胞。纳米疫苗在室温保存至少14天后,其功能仍保持不变。该研究证明稳定和持久免疫水凝胶-LNPs体系可用于有效的肿瘤免疫治疗。
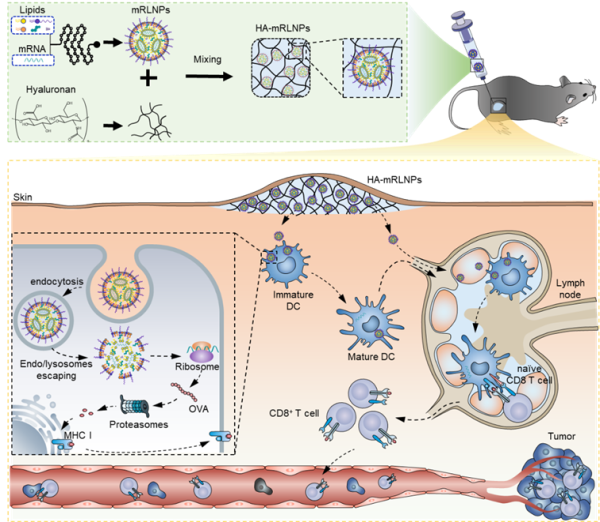 水凝胶-LNPs系统制备和体内肿瘤免疫示意图
水凝胶-LNPs系统制备和体内肿瘤免疫示意图
论文链接:
https://doi.org/10.1002/adma.202205950
https://doi.org/10.1002/adfm.202204636
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言