外周血+脑脊液双样本验证:ctDNA和T细胞受体可预测NSCLC脑转移
2023-03-11 测序中国 测序中国 发表于安徽省
接受颅内放疗的脑转移NSCLC患者的CSF和外周血样本中基因组和免疫状态的纵向特征。血液中的TCR提高了脑放疗后NSCLC患者ctDNA的预后能力,而CSF中的TCR可以独立预测iPFS。
脑转移是晚期非小细胞肺癌(NSCLC)死亡的一个主要原因,常规转移性活检或切除手术的稀缺性限制了脑转移患者诊断和预后的生物标志物的发现。循环肿瘤DNA(ctDNA)来源于肿瘤细胞的坏死、凋亡和分泌,广泛分布于各种体液中,包括外周血和脑脊液(CSF)。在以往的研究中,血液ctDNA和CSF ctDNA的基因组改变已被证明是脑转移的非小细胞肺癌(NSCLC)患者的预后标志物。T细胞受体(TCR)测序技术提供了一种强大的方法来量化T细胞多样性。联合放疗和免疫治疗可以有效延长III期NSCLC患者的生存期,与免疫系统修饰密切相关的TCR也会因放疗而发生改变。
武汉协和医院董晓荣教授团队联合吉因加,对30名接受脑部放疗的脑转移NSCLC患者的外周血和CSF样本,进行TCR和ctDNA测序与分析,描述了这些患者中基因组和免疫状态的纵向特征,为患者的预后提供了潜在的有效指标,为晚期NSCLC脑转移患者的临床管理提供更多的参考。相关研究成果“Integrated circulating tumor DNA and T cell repertoire predict radiotherapeutic response and outcome in non-small cell lung cancer patients with brain metastasis”发表于Cancer Communications杂志(IF=15.283)。
研究背景
该研究共纳入30名接受脑部放疗的脑转移NSCLC患者在基线、放疗后24小时(T0)和28天(T28)收集CSF和外周血,并进行ctDNA和TCR CDR3 beta区域的深度靶向测序。研究发现,在基线时CSF和外周血存在相互独立的基因组和免疫特征;在放疗过程中,外周血和CSF的TCR状态的变化更为敏感。此外,T28节点血液ctDNA和TCR的状态与患者的总生存率(OS)和无进展生存率(PFS)显著相关,并且二者结合可以得到更好的预测效能。CSF中最大克隆丰度也被发现与患者的颅内PFS(iPFS)显著相关。对外周血和CSF的纵向监测可能是预测NSCLC脑转移瘤放疗后反应和预后的一种更有效的方法。
研究结果
1.基线时血液和CSF之间的基因组和TCR存在差异
排除缺乏细胞游离DNA(cfDNA)提取的样本之后,分别在基线血液样本和基线CSF样本中检测到107和153个突变,包括单核苷酸变异和小的插入和缺失。在有配对血液-CSF样本的25名患者中,9名患者的血液和CSF样本之间共享55个(27.4%)突变,而52个突变(25.9%)仅在血液样本中检测到,94个突变(46.8%)仅在CSF样本中检测到。血液和CSF中的top10突变基因的平均等位基因突变频率是相同的,但是各种样本的代表突变基因不同。
在87个血液和77个脑脊液样本中进行了TCR测序后,使用偏最小二乘法判别分析后发现,通过对V和J geneUsage的降维,可以明显区分CSF TCR与血液TCR。基线时血液中的TCR克隆数量明显大于CSF,并且二者的共享克隆很少。以上结果表明,脑脊液和外周血是独立的区间,并表现出不同的基因组进化和免疫特征。
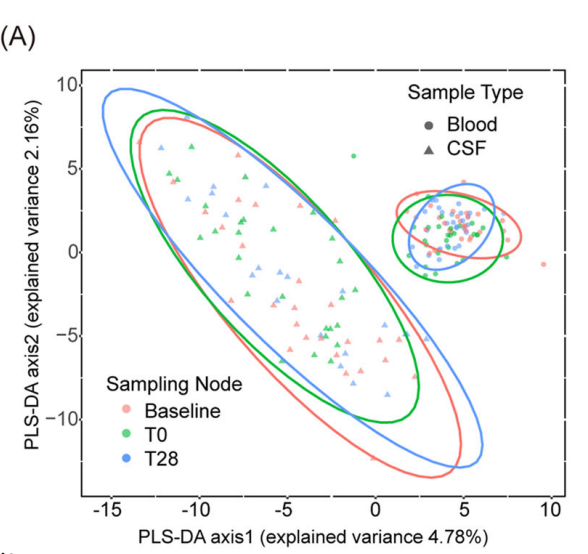
PLS-DA聚类显示了血液(圆圈)和CSF(三角形)TCR的不同V和J基因重组。所有检测TCR结果的样本都包括在内。
2.放疗过程中血液和CSF中TCR多样性改变的差异模式
研究中使用最大等位基因频率(MAF)和肿瘤突变负荷用来评估ctDNA的检测结果,使用香农熵、克隆数和最大克隆频率(MCF)来评估TCR多样性。对比基线时ctDNA和TCR的主要指标,发现血液和CSF之间的MAF、香农熵和克隆数存在显著差异。与基线相比,血液和CSF样本的香农熵在T0时都有所下降。与基线相比,血液样本中的克隆数在T0时明显减少,然后在T28时恢复。然而,脑脊液样本中的克隆数在三个时间点没有显著差异。虽然扩增模式可能不同,血液和脑脊液样本中的MCF在T0时相比基线都有所增加。T28时血液样本中的MCF仍大于基线,但CSF样本中基线和T28之间的MCF没有显著差异。

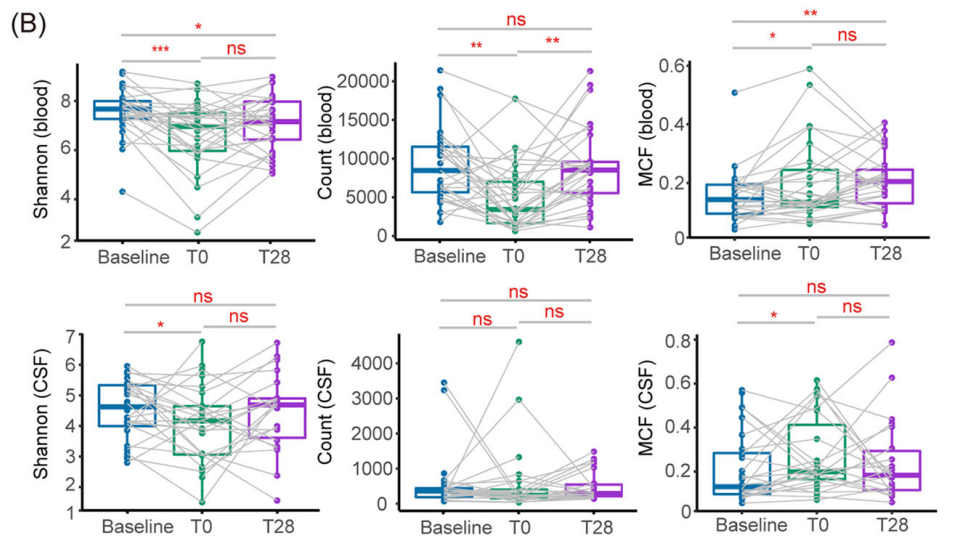
上图表示关于ctDNA MAF、TMB、Shannon entropy、MCF和独特克隆数在血液和CSF之间的比较。下图表示患者血液或脑脊液样本中香农熵,克隆计数和MCF的动态变化。使用配对样本t检验(双侧)进行统计分析。
3.血液ctDNA和TCR在放疗获益患者中的动态变化
在30名患者队列中,颅内和全身化疗的反应率分别为83.3%和76.6%。相比于疾病进展(PD)或疾病稳定(SD)的患者,部分缓解(PR)的患者的血香农熵从基线到T0的动态变化相对更高(P = 0.097 at T0,P = 0.265 at T28),克隆数也表现出了显著持续的增加(P = 0.007 at T0,P = 0.004 at T28),表明PR的患者似乎保持激活的免疫组库状态以抵抗放疗诱导的应激反应。ROC分析进一步评估了血液ctDNA的等位基因频率对区分从放疗中获益的患者的预测作用,曲线下面积(AUC)在T28达到0.74。

不同肺部反应患者的血液TCR参数变化百分比,以及使用ROC分析对基线、T0和T28血样中ctDNA AF的差异化预测能力。
4.综合TCR图谱和ctDNA可预测放疗的结果
在中位随访24个月后,T28时血液中无ctDNA残留或有非劣效性香农熵(定义为TCR多样性)的患者的总生存期(OS)显著增加。当结合观察两个指标时,发现两个指标的组合对OS的预测效能优于单个ctDNA或TCR多样性的预测效能[风险比(HR)= 10.53,P<0.001]。在无进展生存期(PFS)方面也得到了类似的结果。
颅内PFS(iPFS)也被认为是该研究的一个独立终点。CSF MCF增加≥50%的患者比CSF MCF增加<50%的患者的iPFS更长(HR = 8.320,P = 0.011),表明CSF中T细胞克隆的增加可能作为脑转移治疗中放疗的潜在预后标志。

Kaplan-Meier曲线显示了不同血液或脑脊液ctDNA和TCR指标分组的OS,PFS和iPFS。
研究结论
该研究描述了接受颅内放疗的脑转移NSCLC患者的CSF和外周血样本中基因组和免疫状态的纵向特征。血液中的TCR提高了脑放疗后NSCLC患者ctDNA的预后能力,而CSF中的TCR可以独立预测iPFS。该研究进一步扩大了对放疗与脑部免疫系统相互作用的认识,最终为晚期NSCLC脑转移患者的临床管理提供改进意见。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










不错,学习了。
105