JMC:靶向一个蛋白互作的选择性分子胶的理性设计
2022-12-15 精准药物 精准药物 发表于上海
分子胶,也称作蛋白-蛋白相互作用(PPI)稳定剂,是在两个蛋白质之间的界面上相互作用以诱导或增强其PPI亲和力的化合物。
2022年12月9日,药物化学权威期刊JMC在线发表了AstraZeneca研究团队关于设计糖皮质激素受体(Glucocorticoid receptor, GR)选择性分子胶的最新研究成果,其文章标题为“Designing Selective Drug-like Molecular Glues for the Glucocorticoid Receptor/14-3‑3 Protein−Protein Interaction”。
 图1.文章标题
图1.文章标题
分子胶,也称作蛋白-蛋白相互作用(PPI)稳定剂,是在两个蛋白质之间的界面上相互作用以诱导或增强其PPI亲和力的化合物。本文中,作者从糖皮质激素受体(GR)的非经典信号通路出发(GR在T524残基发生磷酸化后与14-3-3蛋白发生PPI相互作用,从而调节病理性炎症和癌症发生)设计了一系列具有一定选择性和细胞渗透性的GR/14-3-3分子胶。接下来我们将简要介绍该文章中GR分子胶的药物分子设计过程。
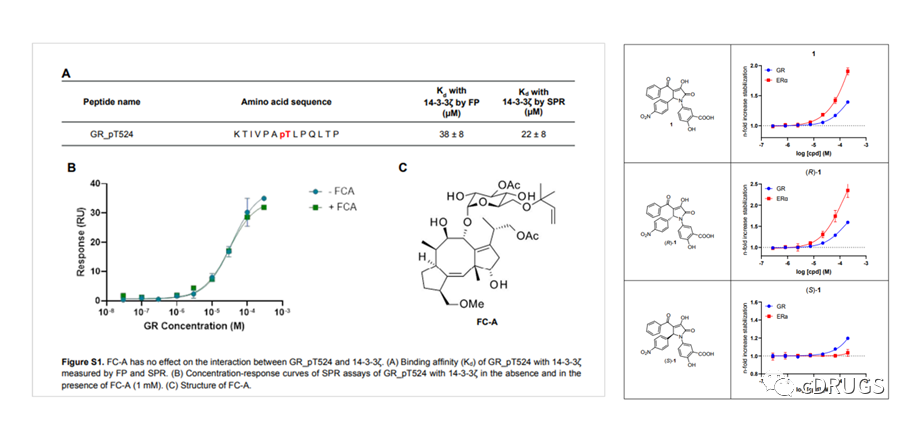 图2.14-3-3分子胶FC-A、化合物1及其异构体对14-3-3/GR PPI的稳定作用
图2.14-3-3分子胶FC-A、化合物1及其异构体对14-3-3/GR PPI的稳定作用
14-3-3蛋白是一类重要且广泛存在的PPI效应蛋白平台,目前已有部分稳定其PPIs相互作用的分子胶被报道,如天然产物FC-A(图2)。FC-A通过占据14-3-3蛋白PPI界面的FC-A口袋从而稳定其PPIs作用,该化合物常被用作工具化合物来研究基于14-3-3蛋白开发的分子胶。但根据报道,由于位阻原因,FC-A不能稳定磷酸化丝氨酸/苏氨酸残基+2位置含有脯氨酸的蛋白伙伴和14-3-3的PPIs作用。GR pT524的+2位置的氨基酸刚好为P526,因此,14-3-3/GR PPI预计对FC-A的稳定不敏感。随后,作者开发了基于14-3-3ζ和GR_pT524的荧光偏振(FP)和表面等离子体共振(SPR)检测方法,发现FC-A的确不影响两者的PPI作用(图2)。化合物1是14-3-3/ERα PPI的分子胶,其可结合FC-A口袋稳定该二元复合物。鉴于化合物1与GR的P526不存在位阻作用,作者利用FP实验评价该化合物对14-3-3/GR PPI作用的稳定能力,然后发现化合物1对14-3-3/GR PPI具有微弱的稳定作用(图2)。随后,作者评价了化合物1的对映异构体(R)-1和(S)-1对14-3-3/GR PPI的影响,发现化合物(R)-1具有更强的稳定作用(图2)。意外的是,虽然(S)-1对14-3-3/ERα PPI的稳定作用基本消失,但对14-3-3/GR PPI保持了弱稳定作用。随后,作者通过分子对接结果显示了(R)-1和(S)-1对14-3-3/ERα和14-3-3/GR产生选择性作用的可能原因(图3)。这些结果为作者设计选择性14-3-3/GR分子胶提供了新的思路。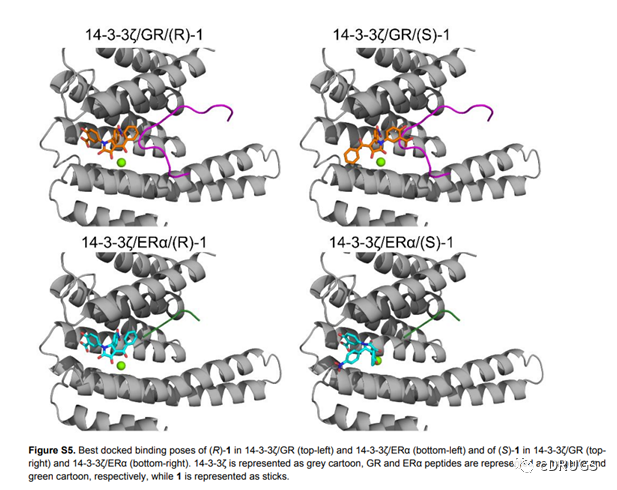
图3.(R)-1和(S)-1分别与14-3-3ζ/GR和14-3-3/ERα的分子对接结果
为了进一步设计对14-3-3/GR PPI具有更优稳定能力和选择性的分子胶,作者分析了化合物(R)-1与14-3-3/GR的共晶结构,从而提出了选择性14-3-3/GR PPI分子胶的分子设计方向(图4)。首先,(R)-1的苯甲酰基(R1取代基)主要与14-3-3的结合蛋白GR发生相互作用,表明该基团是提高化合物选择性的关键;然后,对硝基苯环主要作为氢键供体与14-3-3形成氢键作用,因此作者也探索了其他氢键供体对其稳定能力的影响(R2取代基);最后,(R)-1的水杨酸基团主要与14-3-3σ R42发生相互作用,但极性基团羧基可能影响该分子的细胞渗透性,因此对该基团进一步优化可能有利于其细胞渗透性的提高。
 图4. (R)-1和(R)-18与14-3-3ζ/GR_pT524的共晶结构
图4. (R)-1和(R)-18与14-3-3ζ/GR_pT524的共晶结构
分子优化和改造部分结果如图5所示。对于R1的改造,作者在苯甲酰基苯环上引入氯原子,二氟乙氧基等,或者将苯甲酰基替换为苄基或苯环等,最终发现将苯甲酰基替换为苄基或苯环时可导致化合物对14-3-3/ERα PPI稳定作用的降低或失活,从而增加对14-3-3/GR的选择性。另外,作者对产生选择性的可能性做了分析,对于将苯甲酰基替换为苯环的化合物28,其苯环在结合ER时由于主要暴露于ER的溶剂区而与其缺乏相互作用,但与GR作用时,该苯环能很好的插入GR的一个副结合口袋中,从而导致化合物28对14-3-3/GR选择性和稳定性的增加。对于R2的探究,作者将硝基替换为氢或还原为氨基,其化合物对14-3-3/GR和14-3-3/ERα PPI的稳定作用均丧失,而将对硝基甲苯替换为含氢键受体的苯内酯得到化合物30时,其对14-3-3/GR和14-3-3/ERα PPI的稳定作用能够保持。另外,作者对该化合物进行了共晶结构分析,发现苯内酯的确作为氢键供体与14-3-3的氨基酸形成氢键作用。对于取代基R3的优化,为了减少化合物的极性,作者将水杨酸基团的羧基去除并改变羟基取代位置从而得到化合物22和23,并在Caco-2渗透性测定实验中发现该化合物具有中等的细胞渗透性。值得注意的是,作者还发现对该基团的优化也可导致化合物对14-3-3/GR选择性的增加,从共晶结果来看,该结构主要与14-3-3发生相互作用,其基团的改变如何增加对14-3-3/GR的选择性,作者猜测是由于改变了分子本身的动力学性质。
 图5.化合物改造或优化的部分结果
图5.化合物改造或优化的部分结果
总结
利用GR和ER与同一个蛋白14-3-3均会发生PPI相互作用,作者选择了一个14-3-3/ER的分子胶,然后通过基于结构的药物设计策略设计了第一个具有一定选择性和细胞渗透性的14-3-3/GR分子胶,相比于现阶段分子胶发现仍处于偶然发现的药物开发阶段,该文章提供的药物设计策略为我们后续开发新的分子胶提供了新的思路。遗憾的是,该文章未在细胞水平或动物水平评价该分子的活性。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







