哈佛美女科学家发明「癌可贴」,帅的一塌糊涂
2016-07-28 佚名 奇点网
「云南白药创可贴,有药好的更快些。」这句广告词将创可贴和药联系在一起,成功地把「创可贴有药才好」这一观念深植人心,于是这个创可贴迅速在小创伤市场大获成功,大街小巷随处可见。近日,哈佛医学院Natalie Artzi博士带领她的研究团队把这一观念延伸到癌症治疗领域。他们发明了一种含有三种高科技药物的「癌可贴」,在小鼠模型上大获成功。7月25日,他们的这一重要研究成果刊登在材料学顶级期刊《自然材料
「云南白药创可贴,有药好的更快些。」
这句广告词将创可贴和药联系在一起,成功地把「创可贴有药才好」这一观念深植人心,于是这个创可贴迅速在小创伤市场大获成功,大街小巷随处可见。

近日,哈佛医学院Natalie Artzi博士带领她的研究团队把这一观念延伸到癌症治疗领域。他们发明了一种含有三种高科技药物的「癌可贴」,在小鼠模型上大获成功。7月25日,他们的这一重要研究成果刊登在材料学顶级期刊《自然材料》上(1)。

Natalie Artzi博士(打开Artzi博士实验室的网站,被这张照片惊艳到了)
Artzi博士不仅是哈佛医学院的助理教授,她还是麻省理工学院(MIT)的研究员。在材料科学领域深耕多年。关于这款「癌可贴」,还得从2009年讲起。
当时还在MIT Elazer R. Edelman实验室做博士后研究助理的Artzi发现,很多患者在手术之后,由于黏合剂的问题,伤口难以愈合,或者出现组织黏连,给患者造成不小的痛苦。她认为不同的组织对黏合剂的需求都是不同的,所以一种黏合剂包打天下的做法并不合适。所以,她试图带领团队解决这个问题。
经过一段时间的攻坚,她们发明了一种胶水,这种胶水可以根据组织的不同做一些调整,让胶水以最好的状态去适应组织,目前这种胶水可以用于从小肠到肺等各种组织的缝合。据悉,她们发明的这种胶水是第一种可以根据组织的属性做调整的黏合剂,她们的这一研究成果发在材料学领域顶级期刊之一《Advanced Materials》(2)上。
虽然她们发明的胶水表现已经很好了,但是她们意外的发现,这种胶水在同一种组织上面对不同的疾病,使用效果也是存在差别的。例如,这种胶水在肠癌组织上的效果比健康肠组织好,但是它对有炎症肠组织的粘合效果又比健康肠组织差。
Artzi惊奇的发现,这种不同的表现,跟不同状况下肠组织胶原蛋白(collagen)的含量是有关的。由于胶水材料的特殊性,它的粘合效果在高胶原蛋白的组织上更好。如果以健康组织的胶原蛋白为基准的话,患肠炎的肠组织胶原蛋白含量要低,而癌组织胶原蛋白含量则非常高。这就解释了胶水在不同疾病上表现的差异性。她们的这一重要发现于2015年1月刊登在《科学转化医学》上(3)。
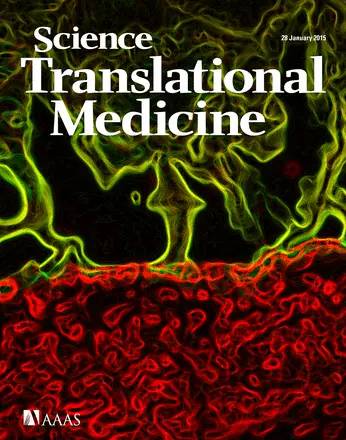
Artzi博士的研究成果被《科学转化医学》杂志以封面的形式刊发(绿色的是水凝胶贴片,红色的是长壁细胞)
真是万万没想到,Artzi最初只是想解决手术后的组织黏合问题,最后却「误打误撞」地跟癌症扯上了关系。这无异于「歪打正着」地挖到了一个金矿啊。科研的神奇莫过于此。既然这个胶水对肿瘤组织有极强的黏附作用,那是不是可以拿它来对肿瘤做点什么?此时Artzi脑子里就有了「癌可贴」这一创意。
不知道Artzi是不是受到云南白药创可贴的启发,她打算把这种水凝胶做成一种载体,在这个载体的表面敷一层药物,然后把这个水凝胶牢牢的贴在肿瘤的表面,让药物精准的渗透到肿瘤组织里,达到治疗癌症的目的。
一开始Artzi就选择挑战最难治的三阴性乳腺癌。这种乳腺癌,几乎没有给科学家留下任何「把柄」,耐药性极强,患者的预后非常差。Artzi选择以多药耐药相关蛋白(multidrug resistant protein 1,MRP1)作为突破点。她打算利用RNA沉默技术干掉让乳腺癌细胞产生耐药性的基因。她首先将用于干掉MRP1的RNA连接到金纳米颗粒上,然后将这些纳米颗粒植入水凝胶中,最后将水凝胶贴到肿瘤生长的部位即可。
随后,Artzi再给小鼠注射化疗药物5-氟尿嘧啶(5-FU),她们发现,在两周之内肿瘤竟缩小了90%。仅仅时隔两个月,2015年3月,《美国科学院院刊》刊登了她们的这一重要研究成果(4)。这意味着,Artzi用水凝胶做治疗癌症药物的载药片这一想法是可行的。

MIT官网挂的图片,附着着癌细胞上的金纳米棒,上面蓝色的是Avastin抗体
这个第一步显然是不能让Artzi满意的,此时的「癌可贴」离真正的治疗性贴片还差很远。因为现在它的作用是解除癌细胞的耐药性,并没有直接的治疗作用。要使它像创可贴那样即贴即用,Artzi必须让「癌可贴」具备治疗功能。为了这个Artzi没少费心思。
这一次,为了提高RNA药物的给药效率,Artzi专门研发了一个RNA给药平台。她们把易降解的RNA链捻成3螺旋状,在这种状态下,易降解的RNA出奇的稳定。有了这项技术,Artzi就把两种可以抑制癌细胞生长的RNA挂在了金纳米颗粒上,再植入水凝胶中,制成可治疗的「癌可贴」。
此次,她们还是以难治的三阴性乳腺癌为研究对象。在给小鼠贴上第二代「癌可贴」后,小鼠的肿瘤在一周内缩小90%,生存时间延长75天,这一治疗效果远远好于传统的化疗。即使与第一代「癌可贴」相比,效果也是明显提高,肿瘤缩小90%的时间竟缩短了一半。本次的研究成果又被材料学顶级期刊《自然材料》刊登(5),距第一代「癌可贴」成果发表仅9个月。
Artzi的研究不可谓不顺利,她的梦想也已经实现。如果换做我的话,我此时应该把工作重心放在去找个企业或者自己组建个公司,申请临床研究。但是Artzi还是把重点放在了寻找进一步提高治疗效果的新方法上。最后,终于做出了本文开始介绍的研究成果--第三代「癌可贴」。(终于绕到正文)
这一代「癌可贴」体现了Artzi的野心,她将这种疗法发挥到了极致。光治疗、基因治疗和免疫治疗,三种高科技一齐在这一代「癌可贴」中亮相。

文章内部的「癌可贴」示意图,以及纳米颗粒上挂的各种药物(倩倩制)
首先,Artzi使用了两种金纳米颗粒,一种是金纳米棒,一种是金纳米球,二者作为药物的载体,上面都挂有将其拉到结直肠癌细胞上的特异性多肽TCP-1,这样可以避免对健康细胞的伤害。其中,金纳米棒不仅是药物的载体,它本身还是一种治疗手段,它在近红外光的照射下会发热,直接摧毁癌细胞。

水凝胶贴片贴到小鼠身上的肿块上之后,用近红外光照射
其次,Artzi在金纳米球上挂了抑制癌基因KRAS表达的RNA,达到抑制癌细胞生长的目的。
再次,Artzi在金纳米棒上挂了贝伐单抗Avastin,Avastin是一种阻碍血管生成的药物,通过抑制血管内皮生长因子的作用阻断对肿瘤的血液供应,以遏制肿瘤的生长和转移。目前,FDA已经批准Avastin用于治疗肺癌、结肠癌和直肠癌,欧盟还批准其用于治疗乳腺癌。

参与本研究的三位博士(从左至右)Joao Conde、Nuria Oliva和Yi Zhang(张同学2007年毕业于复旦大学)
如此「三管齐下」的「癌可贴」表现究竟如何呢?
Artzi首先将第三代「癌可贴」用在了癌症术后恢复上。结直肠癌作为一种对人类威胁非常大的癌症,目前主要的治疗手段是手术切除。然而,多年的数据发现,手术切除之后,复发率为30%-50%。
在结直肠癌小鼠模型上,Artzi发现,术后不使用「癌可贴」,复发率为40%左右;术后使用「癌可贴」,没有出现复发现象。这表明,「癌可贴」彻底摧毁了没有切除干净的癌细胞。
「癌可贴」不仅可以用于术后的恢复,还可以直接用于治疗。当直接使用「癌可贴」时,它可以使肿瘤体积缩小90%以上,小鼠生存时间长达150天以上。这远远超过其他所有疗法,也优于只含一种或者两种药物的「癌可贴」,这些方法治疗后,肿瘤体积只缩小40%-60%,存活时间不超过45天。含有三种药物的第三代「癌可贴」优势显而易见。
实际上,疗效只是第三代「癌可贴」优于其他疗法的一个方面。其他方面还有,相比于传统化疗,「癌可贴」只对它覆盖的肿瘤组织起作用,不会伤害其他的组织和器官。这也在小鼠体内得到验证。相比于手术治疗,「癌可贴」是一种无创治疗手段。而且,Artzi前期的基础研究表明,这种疗法是可以推广用于其他位于皮肤表面和浅层皮肤下的肿瘤(例如肠癌、食管癌、皮肤癌和乳腺癌等)。
Artzi的理想是,「癌可贴」可以用于一些早期癌症的治疗。就拿结直肠癌来说,当医生通过肠镜发现早期的肿瘤时,一般是直接微创切除。Artzi希望以后处理这种早期肿瘤的方法不是切除,而是通过肠镜在肿瘤上贴上「癌可贴」。当然,对于Artzi的这个新技术,需求更大的应该还是术后的缝合上,因为如果用这个贴片去缝合切除癌组织之后的伤口,可以有效的降低癌症的复发和转移率。
据悉,Artzi团队去年就已经组建了公司,不过目前还没有对外公开。不难想到的是,Artzi组建的公司应该是以技术输出的形式存在的。它最快进入临床应用的方式,就是跟药企合作,将那些已经获FDA批准的药物(例如本文中提到的Avastin,它是罗氏的抗癌药物)放到这个「癌可贴」上。
原始出处:
【1】Conde J, Oliva N, Zhang Y, Artzi N. 2016. Local triple-combination therapy results in tumour regression and prevents recurrence in a colon cancer model. Nat Mater advance online publication
【2】Artzi N, Shazly T, Baker AB, Bon A, Edelman ER. 2009. Aldehyde-Amine Chemistry Enables Modulated Biosealants with Tissue-Specific Adhesion. Advanced Materials 21:3399-403
【3】Oliva N, Carcole M, Beckerman M, Seliktar S, Hayward A, et al. 2015. Regulation of dendrimer/dextran material performance by altered tissue microenvironment in inflammation and neoplasia. Science Translational Medicine 7:272ra11-ra11
【4】Conde J, Oliva N, Artzi N. 2015. Implantable hydrogel embedded dark-gold nanoswitch as a theranostic probe to sense and overcome cancer multidrug resistance. Proceedings of the National Academy of Sciences 112:E1278-E87
【5】Conde J, Oliva N, Atilano M, Song HS, Artzi N. 2016. Self-assembled RNA-triple-helix hydrogel scaffold for microRNA modulation in the tumour microenvironment. Nat Mater 15:353-63
原始出处:
Natalie Artzi.Local triple-combination therapy results in tumour regression and prevents recurrence in a colon cancer model.NATURE MATERIALS.25 July 2016
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













厉害!看到我旦的人员参与很开心!
94
#哈佛#
61
#女科学家#
72
良好的药物载体+有效的药物+去除耐药的干扰,令人脑洞大开
116