瑞德西韦治疗重症住院COVID-19患者III期临床数据公开
2020-04-29 医药魔方Plus 医药魔方Plus
4月29日,吉利德公布了瑞德西韦治疗COVID-19重症住院患者的III期SIMPLE研究结果。结果显示,
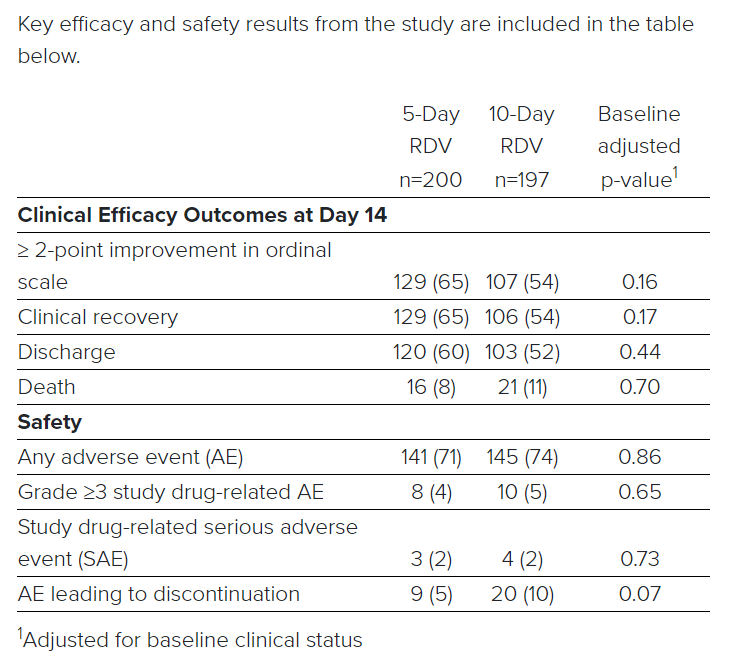
4月29日,吉利德公布了瑞德西韦治疗COVID-19重症住院患者的III期SIMPLE研究结果。结果显示,瑞德西韦10天给药方案和5天给药方案显示出相似的临床改善(第14天的Odds Ratio: 0.75 [95% CI 0.51 – 1.12])。该研究未发现新的安全信号。吉利德计划在未来几天发布详细结果,并交由同行评审。
在本研究中,入组的是氧气水平降低但是不需要机械通气的患者。结果显示,5天疗程组50%患者得到临床改善的时间是10天,10天治疗组50%患者得到改善的时间为11天。两个治疗组中均有超过一半的患者在第14天出院(5天:60.0%;10天:52.3%, p = 0.14)。在第14天,5天疗程组中有64.5%(129/200)的患者实现临床恢复,10天疗程组中,有53.8%(106/197)的患者实现了临床恢复。
临床结果因地理位置而异。在意大利境外,两个治疗组在第14天的总体死亡率均为7%(23/320),第14天有64%( 205/320)的患者经历了临床改善,有61%(196/320)患者出院。
一项探索性研究结果表明,在患者症状发作10天内接受治疗较发作10天后再接受治疗临床结果更佳。汇总各治疗组结果分析显示,第14天时,早期接受治疗的患者有62%的比例出院,而后期接受治疗的患者这一数值为49%。
在5天疗程组和10天疗程组中,瑞德西韦均耐受性良好。两组发生率超过10%的常见的不良事件是恶心(10.0%,8.6%)和急性呼吸衰竭 (6.0%,10.7%)。共有 7.3%(28/385)的患者发生3级以上肝酶(ALT)升高,因为肝酶升高终止治疗的患者为3.0%(12/397)。
吉利德于2月28日在ClinicalTrials.gov上登记该研究(NCT04292899),并于3月6日启动患者招募,原计划入组400例重症COVID-19患者。4月8日,吉利德更新试验方案,将计划入组患者数扩大为2400例,主要终点从体温和氧饱和度正常化患者比例更改为7分顺序量表评估的临床改善率,次要终点从给药10天内发生治疗相关导致的停药患者比例改为给药10~30天内接受任何其他急救疗法的患者比例。4月24日,吉利德再次更新试验方案,将患者人数扩大为6000例。
患者临床状态7分顺序量表
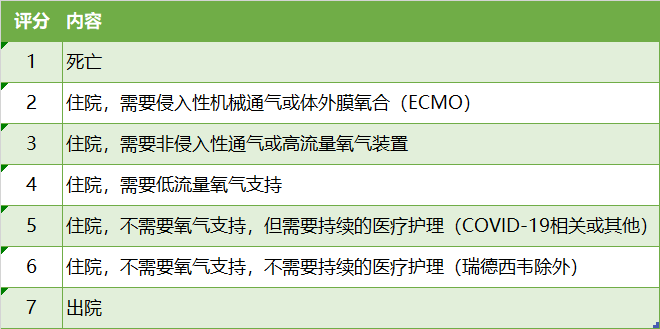
最新的试验方案显示,该研究分为A、B两个部分,A部分主要用于评估患者在标准治疗的背景上接受瑞德西韦5天(第1天静脉给药200mg初始剂量,剩余4个治疗日中每天100mg)和10天(第1天静脉给药200mg初始剂量,剩余9个治疗日中每天100mg)两种给药方案对于未进行机械通气患者的疗效和安全性。B部分研究又分为1个扩展研究和1个针对机械通气患者的研究。
吉利德表示,最近增加的扩展研究将另外招募5600例患者,包括接受机械通气的患者。这项研究正在全球180个试验地点进行,其中包括美国,中国,法国,德国,香港,意大利,日本,韩国,荷兰,新加坡,西班牙,瑞典,瑞士等。这些患者将继续在标准治疗的基础上接受瑞德西韦治疗10天;针对机械通气患者的研究也在接受标准治疗的基础上接受瑞希西韦治疗10天。

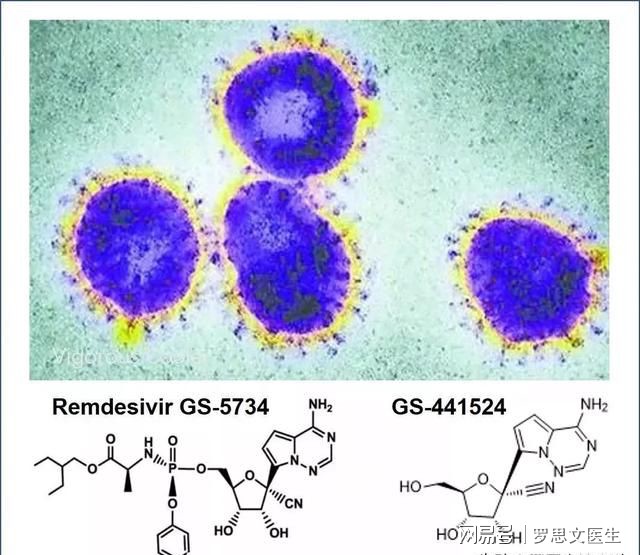
瑞德西韦(Remdesivir)是一种核苷酸类似物,具有广谱抗病毒活性,因其在体外和体内动物模型中证明了对冠状病毒非典型性肺炎(SARS)和中东呼吸综合征(MERS)的病毒病原体均有活性,科研人员推测其可能对2019-nCoV具有潜在的活性。
瑞德西韦
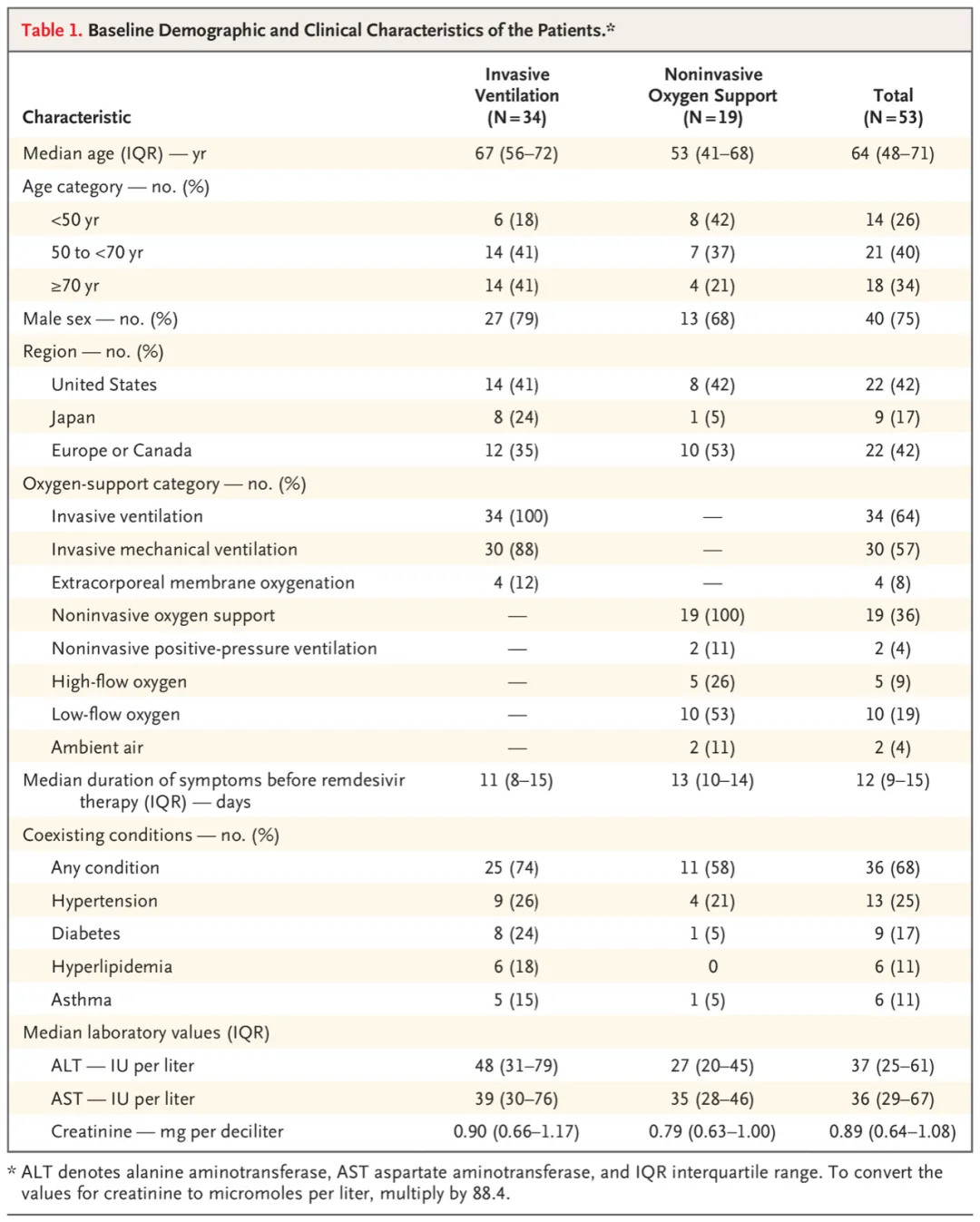
4月10日,吉利德公布的瑞德西韦治疗53例重症COVID-19的同情用药结果显示,有36例患者(68%)的氧气支持分级有所改善;其中,机械通气支持的30例患者中,17例(57%)拔除气管插管。共计25例患者(47%)出院,7例患者(13%)死亡;其中,接受有创通气的患者死亡率为18%(34例患者中死亡6例),而未接受有创通气的患者死亡率为5%(19例患者中死亡1例)。
2月8日,吉利德发表声明称与中国卫生部门达成协议,支持对2019-nCoV感染者开展两项临床试验,以确定瑞德西韦作为冠状病毒潜在治疗手段的安全性和有效性。这两项试验均在武汉进行,由中日友好医院负责协调。患者将接受为期10天的瑞德西韦静脉注射。两项研究的主要终点包括接受治疗后28天的临床症状改善。但在4月,这两项试验先后因入组人数不足而终止。
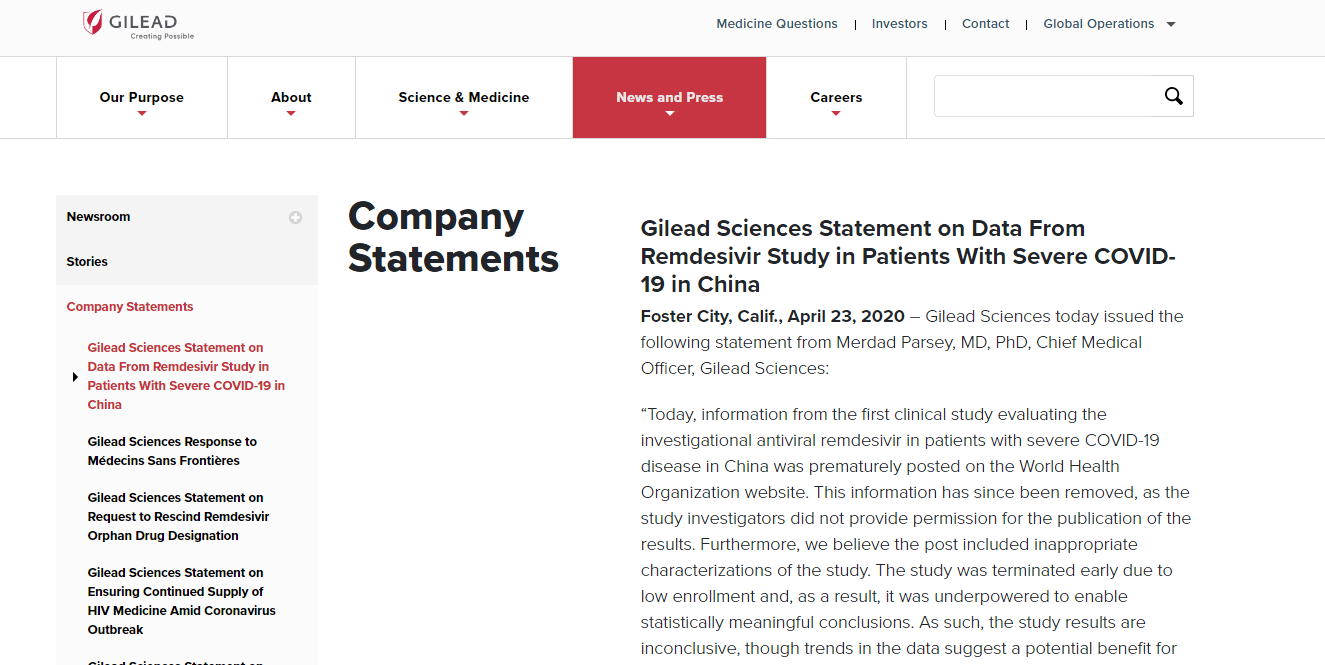
4月23日,STAT news新闻报道瑞德西韦针对中国重症COVID-19患者的研究结果显示,瑞德西韦治疗组(n=158)较对照组(n=79)没有显著降低患者病死率(13.9% vs 12.8%,HR1.23),同时,瑞德西韦组较对照组不良发应发生率较高(65% vs 64%)。结果认为,瑞德西韦治疗未明显改善 COVID-19 重症患者临床症状,同时瑞德西韦组中有 18 例患者(11.6%)因药物副作用提前中止治疗,而安慰剂组这一数值为4(5.1%)。
针对这一事件,吉利德在当天发表的声明中表示,该研究由于入组率低而提前终止,因此,数据不足以支撑有统计意义的结论。目前,关于该研究的现有数据已经提交用于经同行评审的发布,近期将会看到更详细的信息。
从2月初至今,吉利德除积极的和各国监管机构沟通推进临床试验进程外,还启动了针对个例患者的同情用药方案和更多患者的扩大可及方案。
在药物供应方面,吉利德从1月起就采取了迅速扩大生产和增加可供应量的举措,包括改进生产工艺以缩短生产时间,转换设备、扩展外部旨在合作伙伴网络等。吉利德CEO Daniel O’Day在4月5日表示:“瑞德西韦现有供应量共计为150万剂,根据临床试验中正在研究的最佳治疗时间来计算,这一供应量可以满足超过14万个疗程的患者治疗。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#I期临床#
58
#临床数据#
113
#III#
59
#COVID-19患者#
65
#II期临床#
94
#III期#
125