前言
2022年1月14日检验科人员发现一患者的神经元特异性烯醇化酶(NSE)高达125.30ng/ml,而最近的检测结果为3个月的16.90ng/ml。NSE存在于神经组织和神经内分泌组织中,在与神经内分泌组织起源有关的肿瘤中有过量的表达,导致血清中NSE明显升高。该病例为晚期肺腺癌患者,高度怀疑是神经内分泌癌的转变,恰好实验室在做胃泌素释放肽前体(ProGRP)的性能验证实验,该指标同样在神经内分泌癌中的水平显着高于其它疾病。结果显示该患者血清ProGRP高达5000pg/mL,极可能为神经内分泌癌的转变,因此马上联系了临床医生,告知两个肿瘤标志物的检测结果,以便及时明确诊断和指导治疗。以下为患者曲折的诊疗历程。
案例经过
第一阶段:
患者男性,51岁,2019年9月因咳嗽、咳血痰1月入院,入院后完善PET-CT示右肺下叶后基底段占位,考虑肺癌,有肝转移,多发骨转移、淋巴结、肾上腺转移。肺肿瘤六项:NSE 16.76ng/ml,癌胚抗原(CEA)31.80ng/ml↑,CA125 120.10U/ml↑,CA153 63.12U/ml↑,细胞角蛋白片段19(CYFRA21-1)7.76ng/ml↑,鳞状细胞癌抗原(SCC) 1.3U/ml;CEA 和CYFRA21-1的升高提前给临床提示这可能是非小细胞肺癌(NSCLC)。最后经支气管镜活检确诊肺腺癌(T3N2M1 IVB期)(见图1),肿瘤组织基因检测结果显示表皮生长因子受体(EGFR )19号外显子序列缺失突变。予以第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)奥西替尼口服治疗。1月后复查胸部CT示肺肿瘤有缩小(见图2),血清肿瘤标志物均明显下降CEA 145.70ng/ml,CA125 15.24U/ml,CA153 24.97U/ml,CYFRA21-1 3.4ng/ml,2月后腹部CT示肝肿瘤缩小(见图3)。
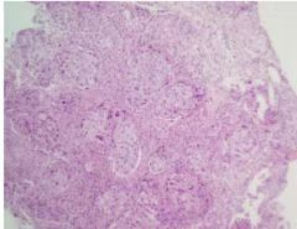
图1 2019-9肺腺癌病理图
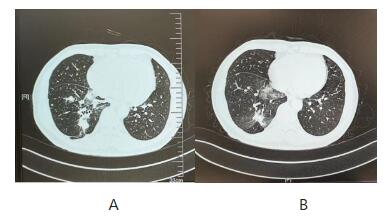
图2 2019-9(A)和2019-10(B)的CT图比较

图3 2019-12腹部CT影像图
第二阶段:
2020年6月患者外周血肿瘤基因检测结果显示EGFR 基因19号外显子序列缺失突变
合并T790M突变,奥西替尼本身是专门针对T790M突变的,此时血清肿瘤标志物显示CEA 89.59ng/ml↑,CA125 12.78U/ml,CA153 7.16U/ml,CYFRA21-1 2.14ng/ml,胸部CT示肺肿瘤较前无进展(见图4A),显示患者病情稳定,于是继续采用靶向药物治疗。2021年3月,患者复查血清CEA 上升到174.70ng/ml,胸部CT提示肺部病灶进展及多个锥体骨转移(见图4B),经肺穿刺活检后进行肿瘤组织的基因检测,结果为在原来突变上伴有c-MET扩增。c-MET扩增是靶向治疗常见的耐药机制之一。根据基因检测结果在奥西替尼的基础上加服针对c-MET扩增的靶向药物赛沃替尼。3个月后复查胸部CT示肺肿瘤较前无进展,但患者CEA呈持续升高至253.9ng/ml。
2021年8月在治疗上采用抗血管+化疗+免疫+靶向,患者血清CEA下降至41.75ng/ml。
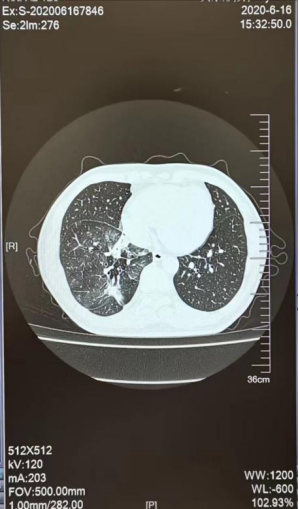
A
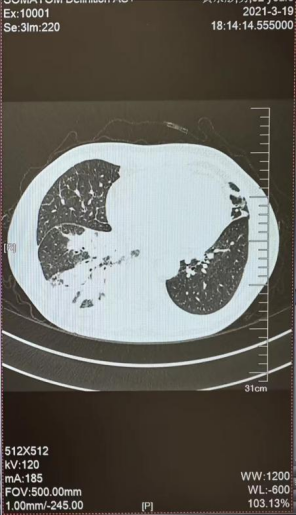
B
图4 2020-6(A)和 2021-3(B) 胸部CT图
第三阶段:
2022年1月,患者的胸部CT提示肺部肿瘤较前明显增大(见图5),检测血清肿瘤标志物结果于是便出现前面所提到的一幕(患者的神经元特异性烯醇化酶(NSE)高达125.30ng/ml)。再次行肺穿刺活检病理诊断为具有大细胞特征的高级别神经内分泌癌(见图6),治疗方案马上更改为化疗+免疫治疗。经上述治疗后患者一般情况明显好转,复查胸部CT示肺部肿瘤病灶明显缩小。。
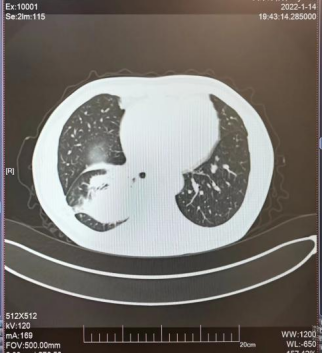
图5 2022-1胸部CT图
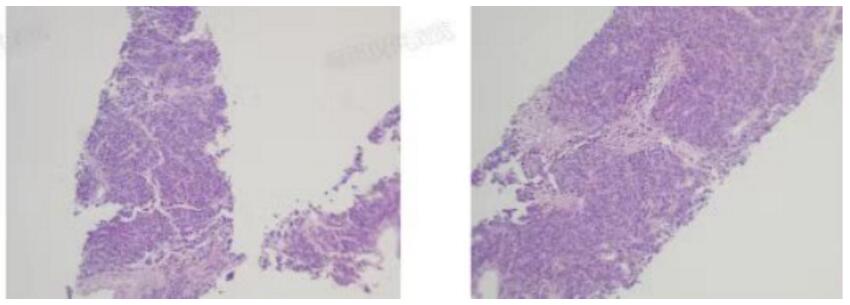
图6 2022-1大细胞特征的神经内分泌癌病理图
案例分析
检验案例分析
回顾两年多的诊疗历程,血清肿瘤标志物的检测贯穿患者靶向治疗的全过程(见图7),并在关键时刻起到了重要的提示作用。初诊时CEA和CYFRA21-1水平升高明显有助于肺腺癌的诊断,使用靶向药物治疗后,治疗过程中CEA血清水平可以预测治疗效果,而靶向治疗过程中有可能发生NSCLC向神经内分泌癌的转变,NSE、ProGRP水平的升高可以预示这一情况的发生。
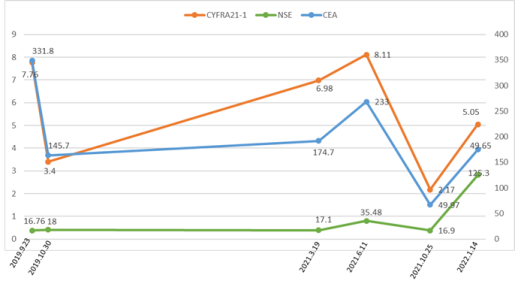
图7 肿瘤标志物曲线图
NSCLC靶向治疗相关基因检测有多种方法,主流平台包括突变扩增系统(ARMS)PCR检测,下一代测序技术(NGS)检测和数字PCR检测等。肿瘤组织是最好的检测标本,当患者无法取得肿瘤组织或用药监测过程中需多次检测基因情况,可采用血液标本作为有效的补充。而且当EGFR-TKI治疗发生进展,优先考虑血浆T790M检测,通过监测血液中EGFR突变情况可以比CT检查更早发现因耐药引起的疾病进展。而MET扩增是由于MET基因局部或者区域的重复,最终都引起了MET的异常表达,导致肿瘤的发生,是较为常见的EGFR-TKI治疗后耐药机制的一种。目前FISH技术在临床中是MET基因扩增的“金标准”,具有灵敏度高、特异性好和操作简便的优势。
临床案例分析
肺癌靶向时代,再谈血清肿瘤标志物。EGFR-TKI治疗前(包括手术前、化疗前、放疗前和靶向治疗前)需要对血清肿瘤标志物进行首次监测,选择对患者敏感的2~3种肿瘤标志物作为治疗后疗效观察的指标。EGFR-TKI治疗后有 50%会产生T790M突变的,约20%的患者有另外一种耐药机制——MET 扩增。在TATTON研究中奥希替尼联合赛沃替尼治疗EGFR-TKI耐药合并MET扩增患者取得了不错的成绩。而免疫检查点抑制剂(ICI)在晚期NSCLC的治疗中发挥着重要作用,ICI 和抗血管生成治疗具有协同抗肿瘤作用,抗血管生成治疗不仅使肿瘤血管系统正常化,而且优化了肿瘤的免疫微环境。肿瘤标志物建议每3个月检测1次,随访中若发现明显升高(高出首次随访值25%),应在1个月内复测1次,如果仍然升高,则提示可能复发或者存在转移,需要进一步的检查。
肺大细胞神经内分泌癌(LCNEC)的生物学特性、临床特性以及预后因素都与小细胞肺癌相似。NSE和ProGRP明显异常升高可提示LCNEC或SCLC转化,为后续治疗方案制定提供重要参考。LCNEC由于其发病率较低以及病理特征较为奇特,目前就其诊疗仍存在很多争议,相关的推荐治疗及预后指标缺少文献数据支持,多数研究都倾向采用小细胞肺癌化疗方案。虽然EGFR 基因19号外显子序列缺失突变合并T790M突变依然存在,但病理类型转化为神经内分泌癌后靶向治疗无效。有认为免疫检查点抑制剂对所有分期较晚、侵袭性较高的神经内分泌癌均有疗效,部分LCNEC可能会显示对免疫治疗反应良好。
知识拓展
关于肺癌的血清肿瘤标志物:NSE和ProGRP是诊断神经内分泌癌较为理想的指标,CEA、SCC和CYFRA21-1水平升高亦有助于NSCLC的诊断。;在治疗过程中CEA血清水平可以预测化疗、靶向治疗和免疫治疗疗效及预后,NSE、ProGRP可以提示病理类型的转化,提示临床及时改变治疗方案。
EGFR-TKI 获得性耐药机制包括以下 4 个方面[1]:EGFR 获得性耐药突变,如 T790M 的突变;旁路激活,包括在相同细胞中重合,或者独特克隆的出现,如 MET、HER2、HER3 的激活;下游通路的激活,如 BRAF 突变或 PI3K 信号通路的激活;组织学类型的转变,如向神经内分泌癌(主要是小细胞肺癌)转化或者发生上皮间质转化(EMT)。
NSCLC发生EGFR-TKI耐药转化为神经内分泌癌的几率为3-15%,神经内分泌癌包括大细胞神经内分泌癌(LCNEC)和小细胞肺癌(SCLC),转化为LCNEC的几率低于SCLC,不超过5%。转化机制目前有两种假说[2,3],一是肿瘤异质性是恶性肿瘤的特征之一,穿刺活检标本仅取部分肿瘤组织,因此诊断具有局限性,不能全面反映整体肿瘤组织的情况,可能同时存在NSCLC和LCNEC细胞成分的异质性肿瘤在活检标本中。另一种在肿瘤干细胞增殖分化的某个阶段,肿瘤干细胞先向NSCLC细胞定向分化,在其增殖发展的过程中,接受某些外界压力,如EGFR-TKI,转化为LCNEC,由于转化的LCNEC细胞仍然携带原有EGFR基因突变,可以证明LCNEC并非新发,而是由原有NSCLC细胞转化而来。
案例总结
本案例中的患者在靶向治疗过程中出现了3种耐药,T790M 突变到c-MET扩增的出现,最后转化为神经内分泌癌,治疗过程可谓艰辛曲折。肺癌血清肿瘤标志物的临床应用贯穿于肺癌诊治全程[4],为靶向治疗保驾护航。肺癌肿瘤标志物检测具有灵敏、高效、标本易获取、创伤小、可量化动态监测等优点,为肿瘤诊断、复发、预后及疗效监测,提供可量化的观察指标。此案例是检验和临床相互沟通和配合的一个成功案例,肿瘤标志物和靶向治疗相随与共,检验与临床在工作中同样也需要相随与共,互相学习,共同进步。
专家点评
林勇平主任技师(广州医科大学附属第一医院检验科副主任)
EGFR突变是肺腺癌患者中最常见的驱动突变,亚洲人的发生率为 50%,欧洲高加索人的发生率为 9.8%。所以EGFR-TKI是“东方人的礼物”,EGFR-TKI显着延长了携带 EGFR 突变患者的生存期,但耐药性和疾病进展是不可避免的,因此,TKI 耐药后的疾病管理已成为一个关键问题,定期的CT和肿瘤标志物检测为肿瘤复发、预后及疗效监测提供量化指标。我科是华南地区最早规范化开展肿瘤基因检测的实验室,目前拥有ARM-PCR、NGS和数字PCR平台,可检测肿瘤组织、血液和细胞学标本,辅助国家呼吸医学中心对大量NSCLC患者进行靶向治疗前判断和用药过程的耐药检测。临床、放射、病理和检验多学科合作,提供恰当、及时的疾病诊断和治疗方案,使病人受益最大化。临床和实验室的合作沟通是必不可小的,如在肿瘤患者的个体化诊疗过程中,关于标本质量的要求(肿瘤细胞数量、血液送检的时效等)、处于判断标准临界的结果、跟临床表现不相符的结果,都需要我们主动跟临床去沟通解决。在这个过程中,大家互相学习,紧密配合,实现以患者为中心的服务理念,共同促进临床与实验部门的共赢发展。
【参考文献】
[1]D Westover , J Zugazagoitia , B C Cho ,et al.Mechanisms of acquired resistance to first- and second-generation EGFR tyrosine kinase inhibitors[J].Ann Oncol, 2018 Jan 1; 29(suppl_1):i10-i19.doi: 10.1093/annonc/mdx703.
[2]Emma Norkowski , Maria-Rosa Ghigna, Ludovic Lacroix,et al.Small-cell carcinoma in the setting of pulmonary adenocarcinoma: new insights in the era of molecular pathology[J].J Thorac Oncol, 2013 Oct;8(10):1265-71.doi: 10.1097/JTO.0b013e3182a407fa.
[3]Chen Y, Tang WY, Tong X,et al.Pathological transition as the arising mechanism for drug resistance in lung cancer[J].Cancer Commun (Lond),2019 Oct 1;39(1):53. doi:10.1186/s40880-019-0402-8.
[4]Holdenrieder S.Biomarkers along the continuum of care in lung cancer[J].Scand J Clin Lab Invest Suppl. 2016;245:S40-5. doi: 10.1080/00365513.2016.1208446.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#标志物#
77