Nature Cell Biology:宋保亮/罗婕团队揭示低密度脂蛋白及其受体通过线粒体降解的新途径
2023-06-09 “生物世界”公众号 “生物世界”公众号 发表于上海
该研究发现了一条存在于类固醇激素合成组织和细胞中的全新的LDL/LDLR运输和降解途径,并揭示了线粒体在LDLR稳态维持中的新功能,为深入理解胆固醇代谢和类固醇激素合成奠定了基础。
低密度脂蛋白(LDL)是运输血液胆固醇的主要载体,过高的LDL水平是心脑血管疾病的关键危险因素。LDL可被细胞表面的低密度脂蛋白受体(LDLR)识别并内吞。经典的LDL/LDLR内吞途径认为,LDL与LDLR首先在酸性的内吞体中发生解离,LDL被运输至溶酶体并水解释放出胆固醇,为细胞所利用,例如作为合成类固醇激素的底物。LDLR则被运回质膜以再次内吞LDL。
2023年6月5日,武汉大学生命科学学院、泰康生命医学中心、细胞稳态湖北省重点实验室宋保亮/罗婕教授团队在 Nature 子刊 Nature Cell Biology 上发表了题为:Delivery of low-density lipoprotein from endocytic carriers to mitochondria supports steroidogenesis 的研究论文。
该研究揭示了一条存在于类固醇激素合成细胞中的新的LDL/LDLR运输和降解途径,并揭示了线粒体在LDLR稳态维持中的新功能,为理解胆固醇代谢和类固醇激素合成提供了新方向。

该研究通过全基因组shRNA筛选,鉴定出定位于线粒体外膜的磷脂酶PLD6是调节LDLR蛋白水平的新因子。PLD6在肾上腺、性腺等类固醇激素合成旺盛的组织中特异性高表达,负责水解心磷脂产生能促进膜融合的磷脂酸PA。
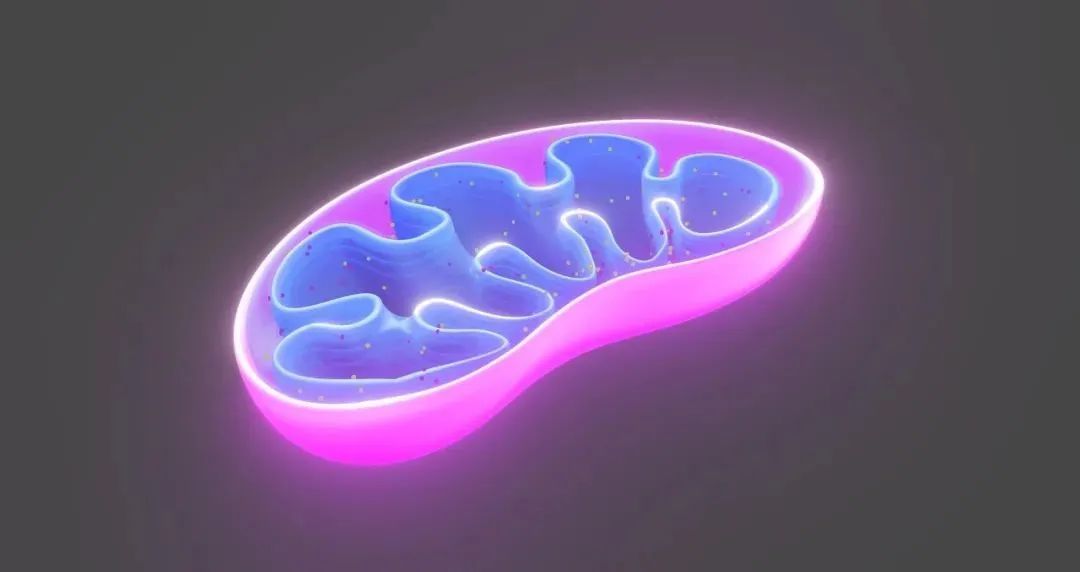
研究团队利用激光共聚焦显微镜和透射电子显微镜等实验技术,明确了LDL/LDLR可转运至线粒体;利用细胞器纯化和体外重构等生化手段,证明了PLD6促进LDL/LDLR囊泡与线粒体发生融合。在线粒体中,LDL胆固醇被用于合成类固醇激素,而LDLR则被线粒体蛋白酶降解。
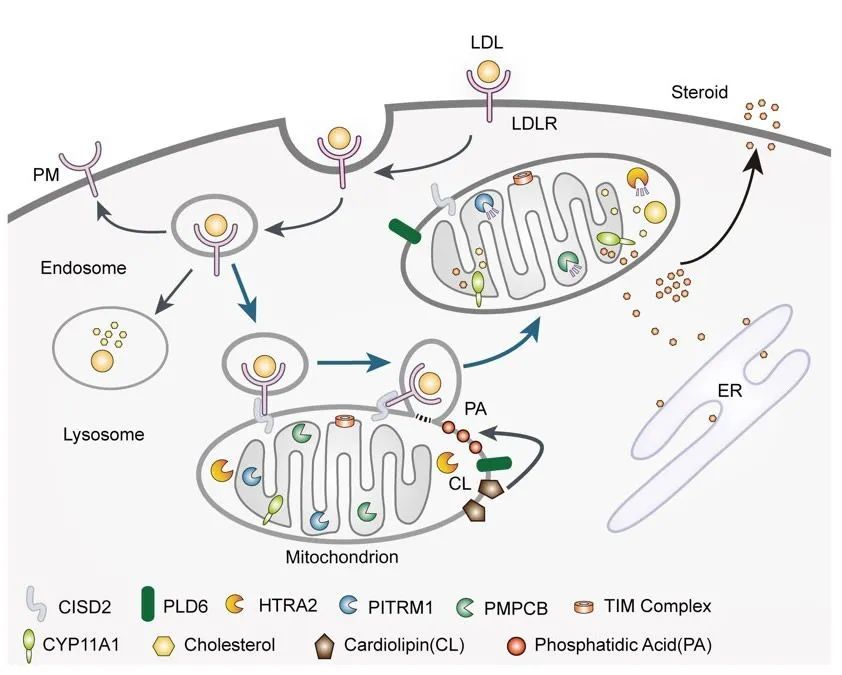
LDL/LDLR转运至线粒体降解的分子机制模型
总的来说,该研究发现了一条存在于类固醇激素合成组织和细胞中的全新的LDL/LDLR运输和降解途径,并揭示了线粒体在LDLR稳态维持中的新功能,为深入理解胆固醇代谢和类固醇激素合成奠定了基础。
武汉大学生命科学学院博士生周玉霞为论文第一作者,宋保亮教授和罗婕教授为论文共同通讯作者,博士后魏健(现为山东大学基础医学院研究员)、博士生胡傲、孙浦雨也参与了部分工作。赵晓璐副教授及硕士生邓港提供了质谱技术协助。该工作得到了基金委、科技部和武汉大学泰康生命医学中心的经费支持。
原始出处:
Zhou, YX., Wei, J., Deng, G. et al. Delivery of low-density lipoprotein from endocytic carriers to mitochondria supports steroidogenesis. Nat Cell Biol (2023). https://doi.org/10.1038/s41556-023-01160-6.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言