【Blood】克隆性血细胞减少症的CCRS预后模型,有助于精准治疗
2024-11-18 聊聊血液 聊聊血液 发表于上海
学者分析了357例CCUS患者,研究了克隆性、血细胞减少症和预后之间的相互作用,并建立三因素预后模型并在独立队列验证,近期发表于《Blood》。
CCUS的CCRS模型
在第5版WHO血液淋巴肿瘤分类正式定义了潜能未定的克隆性造血 (CH)(CHIP),诊断标准包括通过血液或骨髓中存在髓系相关体细胞突变,未诊断为髓系肿瘤 (MN) 或不明原因血细胞减少症,且变异等位基因分数 (VAF)≥2%。如果患者存在不明原因血细胞减少症,则称为意义未明的克隆性细胞减少症(CCUS)。值得注意的是,CCUS具有发展为MN的风险,特别是在具有高危突变模式的患者中(包括剪接突变;DNMT3A、TET2或ASXL1突变;突变数量;VAF)。
了解CCUS需要专门的研究来阐明其风险因素和自然史。因此学者分析了357例CCUS患者,研究了克隆性、血细胞减少症和预后之间的相互作用,并建立三因素预后模型并在独立队列验证,近期发表于《Blood》。

本文要点
1、针对克隆性血细胞减少症患者设计了三因素CCRS模型。
2、CCRS可为患者管理和临床试验资格提供精确的CCUS风险评估。
研究结果
该研究纳入多中心357例CCUS患者,中位70岁。三分之一的患者(n=120 [34%])Hb<10g/dL,其中 30例(25%)为红细胞输血依赖。总体而言,130例(37%)患者PLT<100 ×109/L,24例(7%)患者ANC<1 ×109/L。此外,97例(27%)患者符合意义为明的克隆性细胞减少症和单核细胞增多症(CCMUS)的诊断标准。共鉴定出592个变异,其中最常见的突变为TET2 (n=141[24%])、DNMT3A (n=77[13%])、SRSF2 (n=61[10.3%])、ASXL1 (n=49[8.3%])和U2AF1 (n=27 [4.7%])。中位VAF为31.7%。
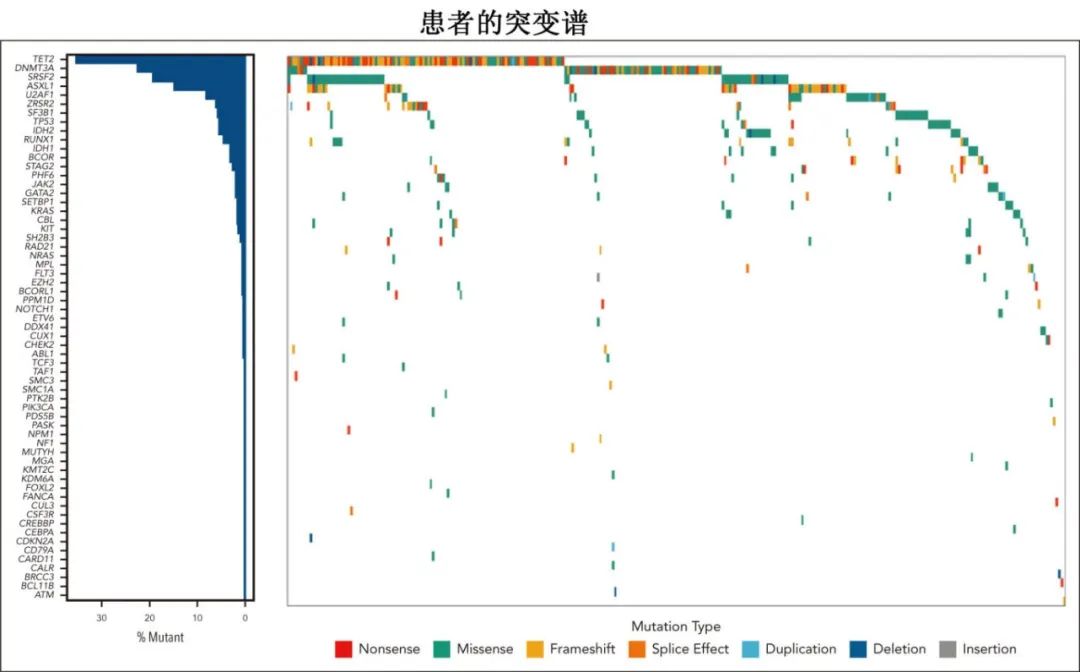
中位随访时间为27.3个月,47例患者(13%)疾病进展为MN;其中30例(64%)进展为MDS,15例(32%)进展为CMML,2例(4%)进展为急性髓系白血病。66例(18%)患者死于各种原因,2年OS为85.4%,2年LFS为87.4%;值得注意的是,细胞遗传学异常但无体细胞突变的患者的2年LFS为83.7%。疾病进展的患者至进展的中位时间为17.1个月。
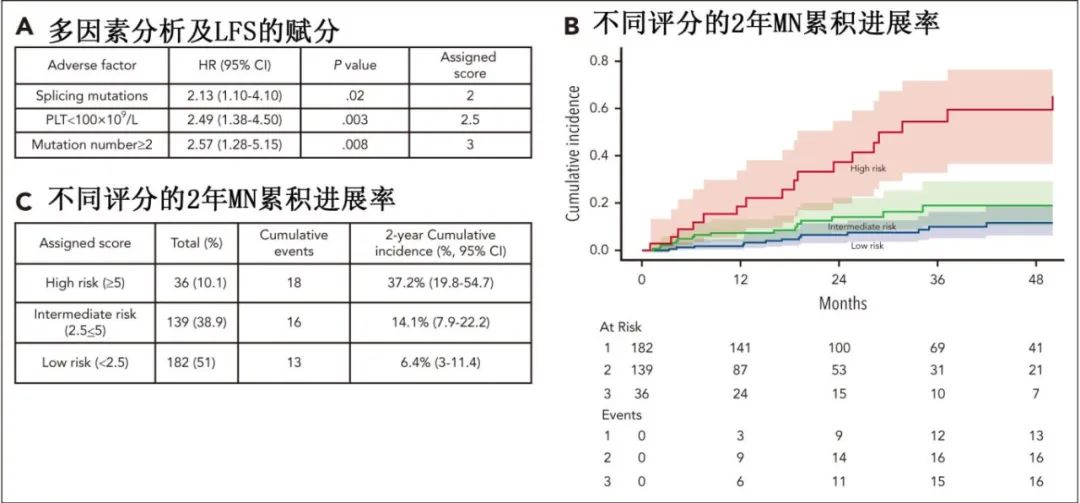
PLT<100×109/L、≥2个突变、存在剪接通路突变是LFS的重要危险因素。

基于上述不良预后因素开发了克隆性血细胞减少风险评分(CCRS):剪接突变(评分=2分)、血小板计数<100×109/L(评分=2.5)和≥2个突变(评分=3),该评分将患者分为低危(评分<2.5分)、中危(评分2.5至<5分)和高危(评分≥5分)组,2年累积MN发病率分别为6.4%、14.1%和37.2%(P<0.0001)。
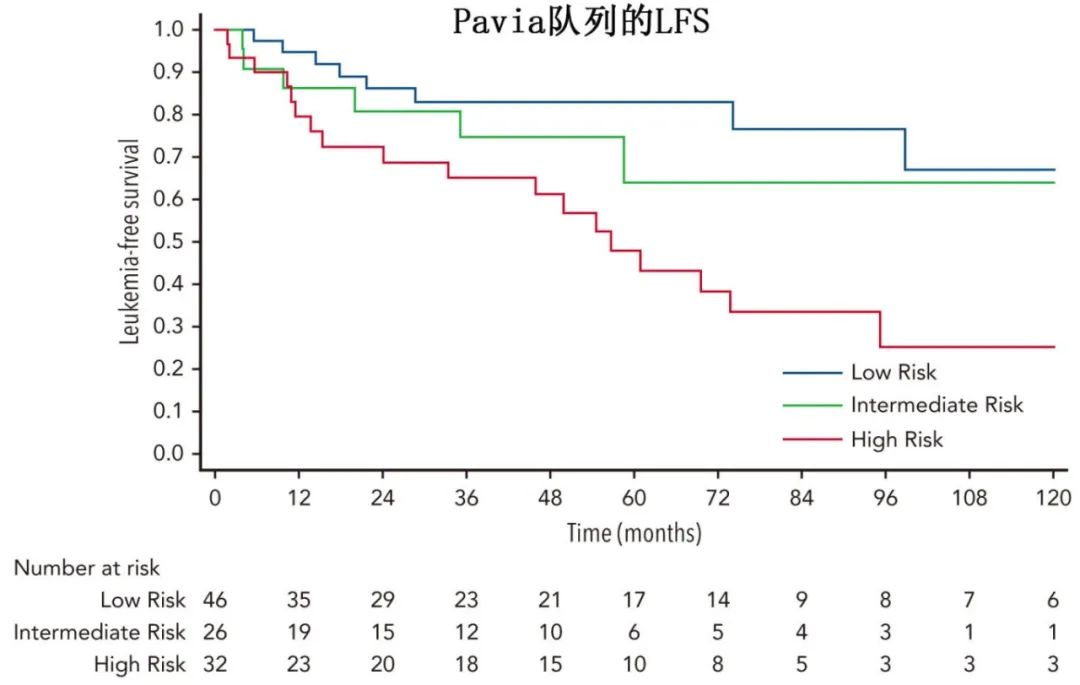
通过将CCRS应用于104例患者的独立CCUS队列(Pavia队列)进一步验证了CCRS模型;在MN累积发病率的分层中,c指数为0.64(P=0.005)。
总结
作者系统地研究了克隆性细胞减少症患者的临床和实验室特征,强调了整合临床和分子学数据来评估CCUS进展风险的重要性,针对CCUS患者设计了三因素CCRS模型,可作为一种实用且易于计算的工具。CCRS的实施具有重要的临床意义,可提供精确的风险分层,指导患者管理,并有助于未来临床试验的资格评估,制定反应标准,以及进一步研究,以解决对治疗CCUS的新疗法的迫切需求。
参考文献
Xie Z,et al.Risk prediction for clonal cytopenia: multicenter real-world evidence.Blood . 2024 Jul 12:blood.2024024756. doi: 10.1182/blood.2024024756.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#克隆性血细胞减少症# #CCRS#
29