Nat Commun:科学家们找到新的治疗癌症的方法
2016-05-31 佚名 生物谷
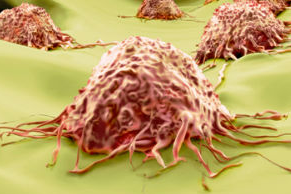
(图片摘自www.sciencealert.com) 科学家们发现一种能够杀死癌细胞的新方法,即利用机体自身的细胞清除功能。来自澳大利亚研究者们通过激活细胞内部一种叫做"BAK"的蛋白质,从而促使癌细胞死亡。 "我们发现了一种全新的激活Bak蛋白的方式,这十分令人兴奋",来自Walter and Eliza Hall医学研究所的研究者之一Ruth Kluck说道。 Bak是我们体内正常

(图片摘自www.sciencealert.com)
科学家们发现一种能够杀死癌细胞的新方法,即利用机体自身的细胞清除功能。来自澳大利亚研究者们通过激活细胞内部一种叫做"BAK"的蛋白质,从而促使癌细胞死亡。
"我们发现了一种全新的激活Bak蛋白的方式,这十分令人兴奋",来自Walter and Eliza Hall医学研究所的研究者之一Ruth Kluck说道。
Bak是我们体内正常情况下介导细胞凋亡的关键蛋白。凋亡作用能够帮助清除我们不需要的细胞,但一旦这一蛋白失去功能,癌细胞就会不受控制地增殖。
通过对Bak蛋白三维结构的分析,该研究组找到了一种能够特异性结合Bak蛋白并将其激活的抗体。之后他们利用该抗体进行了功能学检测。
"目前我们对如何激活Bak蛋白并用于治疗癌症等凋亡异常导致的疾病抱有极大的兴趣",Kluck说道:"这一发现给与我们新的治疗该类疾病的思路"。
科学家们早已知道一类叫做BH-3的蛋白质家族能够激活Bak,但如今他们找到了一类新的激活方式。下一步,他们计划将这类抗体制作成药物导入细胞内部,并在活体水平进行检测。
该类药物同样适用于治疗自体免疫疾病。在自体免疫病发病过程中,凋亡功能的失效导致免疫细胞异常地攻击机体自身的细胞组织。因此,Bak能够对这些细胞同样进行杀伤。
这是癌症研究最为激动人心的时代,科学家们在传统的放疗与化疗之外,正一点点地开发新的癌症疗法。
比如,我们开发出能够将化学药物输送到脑部的纳米颗粒,以及我们对癌症的认识正在一步步地加深。希望包括Bak抗体在内,这些新的研究成果能够有效地帮助治疗癌症。
相关结果发表在最近的《nature communication》杂志上。
原始出处
Sweta Iyer, Khatira Anwari, Amber E. Alsop, Wai Shan Yuen, David C. S. Huang, John Carroll, Nicholas A. Smith, Brian J. Smith, Grant Dewson & Ruth M. Kluck.Identification of an activation site in Bak and mitochondrial Bax triggered by antibodies.Nat Commun.2016
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#COMMUN#
67
#Nat#
72
另一思路呗 加油
148