【AASLD2024速递】乙肝新药Xalnesiran II期研究48周随访结果公布:获得HBsAg清除后再停用NA更安全
2024-11-28 雨露肝霖 雨露肝霖
AASLD2024会议展示乙肝新药进展。Piranga研究(II期)涉及多种药物组合治疗慢乙肝患者,公布48周随访NA停药结果,讨论停药标准、相关定义、研究发现,强调安全停药和联合治疗优势。
编者按
第75届美国肝病研究学会年会(AASLD 2024)于当地时间2024年11月15日至18日在美国圣地亚哥举行。会议期间披露多项乙肝新药研究进展,肝霖君精选其中的重要进展与大家分享。
Xalnesiran即RG6346,是Roche和Dicerna共同开发的一款siRNA药物;Ruzotolimod即RG7854,是Roche开发的一款TLR-7激动剂,目前这两种药物均处于II期临床阶段。在EASL2024大会公布的II期Piranga研究阶段性结果显示,xalnesiran + NA、xalnesiran + ruzotolimod + NA、xalnesiran+ PegIFNα + NA治疗48周的HBsAg清除率分别为7%、18%和30%,停药随访24周的HBsAg清除率分别为7%、12%和23%,停药随访48周的HBsAg清除率分别为10%、12%和17%。
本次AASLD2024大会公布了Piranga研究48周随访期间NA停药的结果,显示基于xalnesiran治疗患者有47%达到NA停药标准,32%停止NA治疗,停止NA治疗的患者中23%在NA停药时达HBsAg清除,其中xalnesiran + ruzotolimod + NA组、xalnesiran + PegIFNα + NA组停止NA治疗的患者中分别有29%和50%在NA停药时达HBsAg清除;NA停药时实现HBsAg清除的患者相比未清除患者更少出现病毒学复发(2/9,22% vs. 17/31,55%)和HBsAg反弹(2/9,22% vs. 24/31,77%)。

研究方法
Piranga研究是一项II期研究,159例NA经治获病毒学抑制的慢乙肝患者随机分为以下五组:
Arm 1:xalnesiran 100mg + NA;
Arm 2:xalnesiran 200mg + NA;
Arm 3:xalnesiran 200mg + ruzotolimod 150mg + NA;
Arm 4:xalnesiran 200mg + PEG IFNα 180μg + NA;
Arm 5:NA对照组
治疗48周,停药随访48周。所有患者维持NA治疗直到治疗结束时或停药随访期间达到NA停药标准。对NA停药的患者严格监控,若满足NA重启标准则重新启动NA治疗。
NA停药标准:ALT < 1.25 × 基线值,HBV DNA < 20 IU/mL,HBeAg阴性,HBsAg清除或HBsAg < 100 IU/mL且相比基线下降≥1 log10 IU/mL。
NA重新启动治疗标准:HBV DNA > 20000 IU/mL;或HBV DNA > 2000 IU/mL 且ALT > 1.5 × ULN;或HBV DNA > 2000 IU/mL、ALT ≤ 1.5 × ULN且7天内复查确认HBV DNA > 2000 IU/mL;或临床显著的肝功能减退迹象(基于实验室结果或临床评估)。
病毒学复发(VR)定义为HBV DNA > 2000 IU/mL。
临床复发(CR)定义为HBV DNA > 2000 IU/mL且ALT > 2 × ULN。
HBsAg反弹定义为HBsAg清除的患者其HBsAg水平≥0.05 IU/mL或未HBsAg清除的患者其HBsAg水平> 1.5倍NA停药时的HBsAg水平。
研究结果
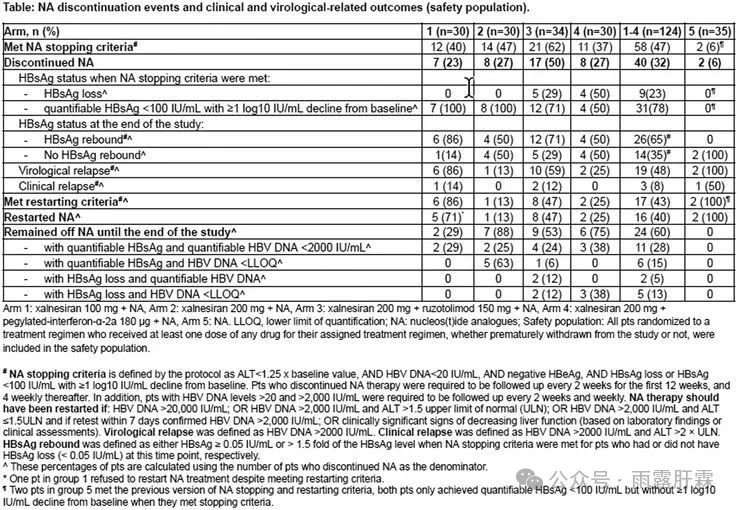
在接受xalnesiran治疗(Arm 1 - 4)的124例患者中,58例(47%)达到NA停药标准,40例(32%)停止NA治疗。在这40例患者中,分别有48%(19例)、8%(3例)和40%(16例)出现VR、CR和重新启动NA治疗。
停止NA治疗的患者中共有23%(9/40)在NA停药时达HBsAg清除,其中xalnesiran + PegIFNα + NA组(Arm 4)在NA停药时达HBsAg清除的患者比例最高,为50%(4/8);其次为xalnesiran + ruzotolimod + NA组(Arm 3),为29%(5/17),其它组无患者在NA停药时达HBsAg清除。
达到NA停药标准时HBsAg清除的9例患者有2例出现VR,分别是在NA停药后的4、6个月发生VR且均不符合CR标准;达到NA停药标准时未HBsAg清除的31例患者中有17例出现VR。3例CR患者均保留肝功能,已病情缓解,无后遗症。
在停用NA的40例患者中,有26例(65%)出现HBsAg反弹,停用NA后的观察时间与未HBsAg反弹的患者相当。在达到NA停药标准时HBsAg清除和未清除的患者其HBsAg反弹率分别为22%(2/9)和77%(24/31)。此外,出现HBsAg反弹和未反弹的患者在达到NA停药标准时的中位HBsAg水平分别为12(0.05 - 98)和0.06(0.05 - 13)IU/mL。
NA停药事件及临床、病毒学相关结局
研究结论
Piranga研究表明,通过预先设定停药和重新启动治疗标准,以及严格的安全监测,可以安全停用NA。进一步研究评估NA停药结局的预测因素对提高有限临床治愈过程中NA管理的成功至关重要。
肝霖君有话说:
有限疗程治疗后实现临床治愈是目前慢乙肝治疗追求的理想目标。NA治疗通常HBsAg清除率低且复发风险高,已有研究证实获得HBsAg清除后再进行NA停药更为安全可靠,且HBsAg清除也极大降低了远期不良结局的发生。
本研究在乙肝新药xalnesiran、ruzotolimod与PegIFNα、NA的不同联合治疗方案中,xalnesiran + PegIFNα + NA组实现NA停药的患者中达HBsAg清除的患者比例最高,占50%;该研究也证实了HBsAg清除的患者相比未清除患者在停用NA后有更低的病毒学复发和HBsAg反弹率。Xalnesiran联合PegIFNα治疗有利于促进HBsAg清除并实现安全停药。
参考文献:
Hou JL, Xie Q, Zhang WH, et al. Outcomes of nucleos(t)ide analogue discontinuation in chronic hepatitis B participants treated with xalnesiran with and without an immunomodulator: 48 weeks of follow-up results from the phase 2, randomized, controlled, adaptive, open label platform study Piranga. AASLD2024, Abstract (252).

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#乙肝新药# #AASLD2024#
21