黄晓军院士等发文,阐述优化非去除T细胞单倍型造血干细胞移植的中国经验
2024-12-25 聊聊血液 聊聊血液 发表于陕西省
《Haematologica》近日发表综述,汇总了近年来优化HID HSCT方案的最新进展,通讯作者为北京大学人民医院黄晓军院士,共同第一作者为莫晓冬教授和裴旭颖教授。
单倍型亲缘供者(HID)造血干细胞移植(HSCT)近几十年来取得重大进展,基于粒细胞集落刺激因子(G-CSF)和抗胸腺细胞球蛋白(ATG)的方案以及基于移植后环磷酰胺(PTCy)的方案代表着目前HID HSCT中非去除T细胞的两个方向。近期多项关键移植技术的优化进一步改善了造血重建,降低了移植后复发和移植物抗宿主病(GVHD)的发生率,并将HID HSCT的应用推广到老年患者和血液系统良性疾病患者。特别是将HID HSCT与新型免疫治疗相结合可进一步提高其疗效和安全性。
《Haematologica》近日发表综述,汇总了近年来优化HID HSCT方案的最新进展,通讯作者为北京大学人民医院黄晓军院士,共同第一作者为莫晓冬教授和裴旭颖教授。

1.引言
异基因造血干细胞移植(allo-HSCT)是血液系统恶性肿瘤最重要的治疗方法之一,人类白细胞抗原(HLA)相合同胞供者(MSD)是allo-HSCT的首选供者,但许多患者缺乏MSD。北京大学血液病研究所使用的G-CSF和ATG及约翰霍普金斯大学移植团队使用的PTCy,均可诱导免疫耐受,克服HLA不合屏障,从而促进HID HSCT的快速发展和广泛应用。
由于移植物排斥和重度GVHD发生率高,2000年前HID HSCT的临床预后较差。尽管体外去除T细胞方案可预防重度GVHD(表1),但移植后复发和感染发生率仍显著影响HID HSCT受者的生存期。
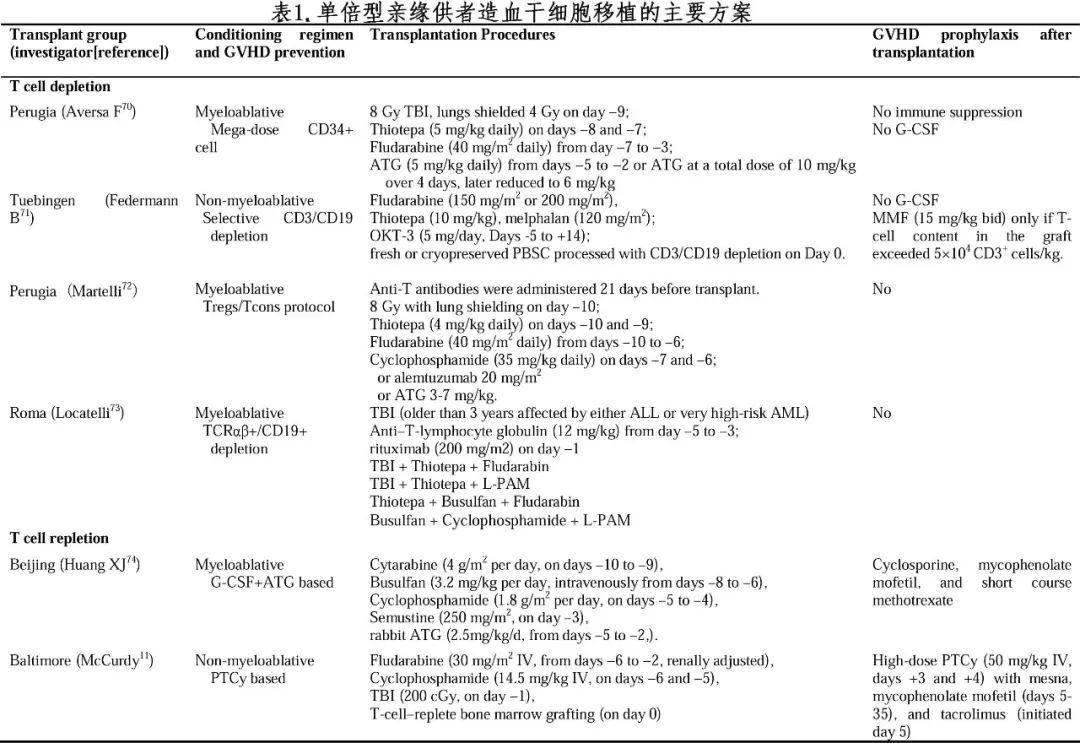
基于G-CSF和ATG为基础的方案诱导免疫耐受,黄晓军院士等建立了“北京方案”,后续经过对主要移植技术的不断优化,显著改善HID HSCT移植预后。多项多中心前瞻性研究证实,在急性髓系白血病(AML)或急性淋巴细胞白血病(ALL)中,接受HID HSCT的临床结局明显优于仅接受巩固化疗的患者,且与接受MSD HSCT的患者相似。根据中国血液和骨髓移植登记组的报告,目前“北京方案”占中国HID HSCT的90%以上;此外,HID HSCT占allo-HSCT的比例从2008年的29.6%(313/1062)上升到2019年的63%(7977/31525)。
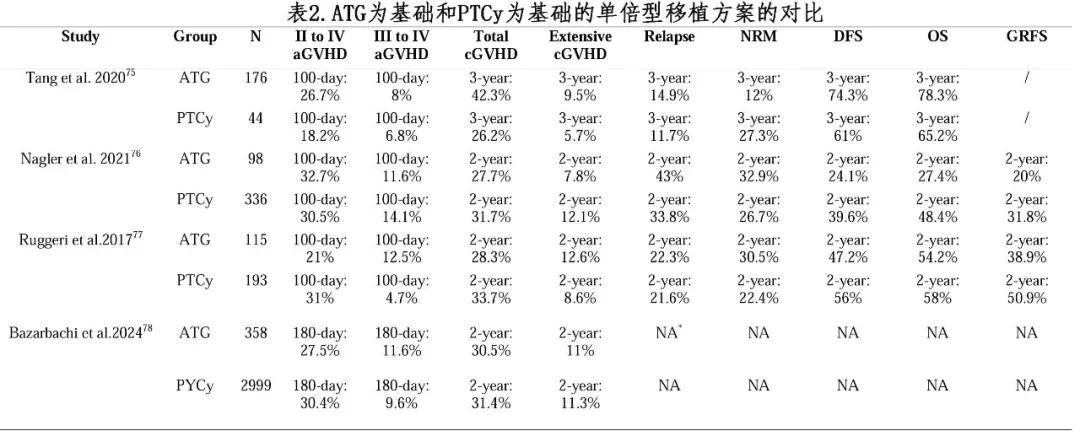
约翰霍普金斯大学提出了以非去除T细胞和移植后环磷酰胺(PTCy)为基础的方案来克服HLA不合。按照该方案,HID HSCT后的植入率、GVHD发生率和长期生存率分别为88-91%、16-42%和40-65%(表1)。多项研究比较了北京和PTCy方案进行HID HSCT的疗效和安全性,提示两种移植方案疗效相当(表2)。
HID HSCT已在全球广泛使用,多项技术的优化也进一步提高了其疗效和安全性。
2.优化HID HSCT后造血重建
植入不良(poor graft failure,PGF)定义为骨髓增生(BM)低下伴以下2个或3个特征:(1)中性粒细胞≤0.5×109/L;2)血小板≤20×109/L;和/或(3)移植+28天后连续3天血红蛋白浓度≤70g/L,或依赖血小板和/或红细胞输注和/或G-CSF支持;随着HID HSCT使用的增加,PGF也成为最重要的移植并发症之一。HID HSCT后PGF的发生率为4-5%;但可严重影响生活质量,增加非复发死亡(NRM)风险。
2.1针对HID HSCT后造血重建不良的新型、发病机制指导的方案
BM微环境对于造血干细胞(HSC)的调节至关重要,而内皮细胞(EC)在调节造血中发挥着重要作用。Kong等人证实,HSCT前BM EC缺陷和HSCT后早期BM EC重建受损与氧自由基(ROS)水平呈正相关,HSCT前BM EC<0.1%可识别HID HSCT后植入不良的高危患者。在一项随机对照试验(RCT)中,将BM EC<0.1%的HID HSCT受者随机分配至N-乙酰基-L-半胱氨酸(NAC)预防组(A组)或非预防组(B组)。NAC预防可改善高危患者HSCT后BM EC和CD34+细胞水平,降低ROS水平,并降低HID HSCT后植入不良发生率。
2.2细胞治疗用于HID HSCT后植入失败(GF)
二次移植是GF最强的挽救性细胞治疗。Ma等人报告了用于二次移植的新方案,主要包括氟达拉滨(30mg/m2/天,第-6天至第-2天)和环磷酰胺(1000mg/m2/天,第-5天至第-4天)组成的预处理方案,换用不同的供者,并使用G-CSF动员的BM(G-BM)和外周血(PB)干细胞(G-PB)采集物。与历史对照相比,新方案的中性粒细胞植活率(100% vs. 58.5%,P<0.001)、血小板植活率 (75.8% vs. 32.3%,P<0.001)和总生存期(OS;60.0% vs. 26.4%,P=0.011)均显著改善。
除了二次移植外,Fei等人使用CD34+干细胞输注治疗HID HSCT后的GF患者(n=12),CD34+细胞的中位数为1.9×106/kg,结果10例患者获得造血重建且无严重不良事件及GVHD。Sun等人使用单纯G-PB治疗allo-HSCT后GF患者(79%为HID HSCT受者),输注的单个核细胞中位数为2.0(1.0-5.8) ×108/kg;53.6%(15/28)的患者造血恢复,G-PB输注后GVHD率为28.6%。但这些结果还需在大样本、多中心研究中进一步证实。
3.优化HID HSCT后GVHD预防和治疗方案
3.1改善HID HSCT后的GVHD预测
细胞因子信号转导抑制因子1(SOCS1)是多种炎性细胞因子的负调控因子,可促进T细胞活化,对GVHD的发病至关重要。Guo等人观察到SOCS1可通过抑制集落刺激因子3受体/Janus激酶2/信号转导子和转录激活子3通路抑制T细胞活化,并且T细胞中SOCS1的高表达与HSCT后较低的急性GVHD(aGVHD)发生相关。这些结果表明,SOCS1可能是预防GVHD的潜在靶点。
Chang等人报道,BM移植物CD4:CD8比值可预测HID HSCT后aGVHD的发病风险。根据该生物标志物,HID HSCT受者可分为低危和高危组,低剂量糖皮质激素预防可降低高危患者I–IV度aGVHD、II–IV度aGVHD和中重度慢性GVHD (cGVHD)的发生率。为了进一步整合aGVHD的危险因素,Shen等人建立了HID HSCT后重度aGVHD风险的综合预测模型(包括年龄、性别、供者/受者关系、外周血移植物中CD3:CD14比值和CD8+细胞绝对计数)。
3.2改善HID HSCT后的GVHD预防方案
钙调磷酸酶抑制剂(CNI;如环孢素和他克莫司)是HID HSCT后GVHD预防的基石。一般认为环孢素预防至少应维持6-12个月;但考虑到复发和肾毒性增加的风险,也有学者探索了CNI早期逐渐减量的可行性。在Yaman等人的一项研究中,计划从HID HSCT后第45天至第60天停用环孢素,结果31例患者中仅14例发生GVHD(aGVHD:9例;cGVHD:3例;重叠GVHD:2例)。但该结果需在前瞻性大队列研究中进一步证实。
为进一步降低GVHD的风险,不少学者探索将ATG联合标准剂量PTCy(表3)或低剂量PTCy(表4)。
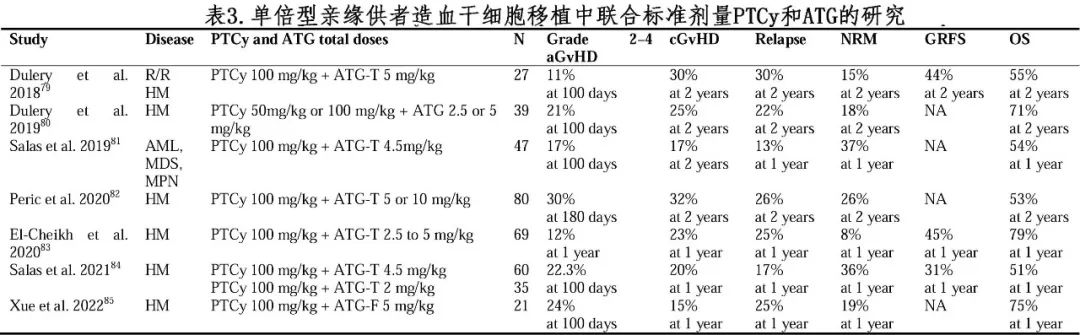
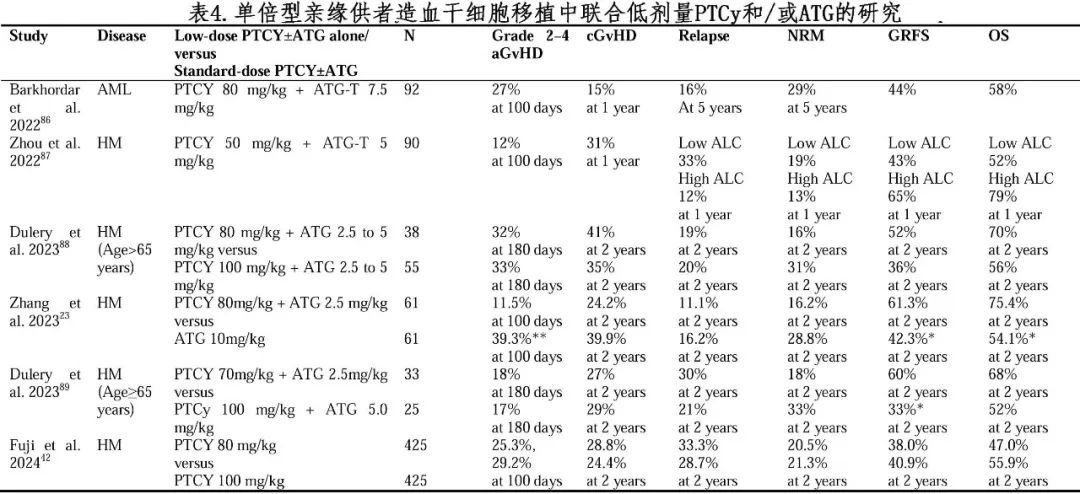
在一项随机对照试验中,122例患者按照1:1随机分配至低剂量PTCy/ATG(PTCy:80mg/kg,ATG:2.5mg/kg)组或标准剂量ATG(ATG:10mg/kg)组。与标准剂量ATG组相比,低剂量PTCy/ATG组aGVHD发生率降低,生存率提高。此外,Wang等人联合兔ATG(10mg/kg)与低剂量PTCy(29mg/kg Cy)用于母系或旁系供者HID HSCT的GVHD预防,结果显示与ATG单药(10mg/kg)相比,联合方案显著降低重度aGVHD (18%vs. 5%,P=0.003)和NRM (15% vs. 6%,P=0.045)的发生率,且改善无GVHD/无复发生存率(GRFS,63% vs. 48%,P=0.02)。
除ATG联合PTCy外,Xia等人探索了ATG联合巴利昔单抗用于HID HSCT后GVHD预防。Ⅱ-Ⅳ度和Ⅲ-Ⅳ度aGVHD的100天累积发生率分别为15.8%和5.0%,而总体和广泛型cGVHD的2年累积发生率分别为9.8%和4.1%。
吗替麦考酚酯(MMF)是预防移植后GVHD的另一个重要药物。最近的研究优化了MMF预防的剂量和持续时间。Elmariah等人报道称,与高剂量组相比,低剂量MMF(<29mg/kg/天)暴露与复发和无进展生存期(PFS)改善相关,且不增加GVHD的风险。此外多位作者观察到,与接受长疗程MMF预防(移植后第45-60天停药)的患者相比,接受短疗程MMF预防(停药直至中性粒细胞植入)的患者在HID HSCT后出现EB病毒再激活和EB病毒相关淋巴增殖性疾病风险降低,且未增加aGVHD或cGVHD的风险,这可能与短疗程MMF改善HID HSCT后30天至90天Vδ2+ T细胞重建有关。因此,HID HSCT后达到中性粒细胞植入时即可停止MMF预防。
4.优化HID HSCT后复发预防方案
多项研究报道,高危白血病患者可从HID HSCT中获益。Guo等人表明,HID HSCT后较强的移植物抗白血病作用主要是与细胞凋亡减少和细胞毒性细胞因子分泌增加有关,包括肿瘤坏死因子-α、干扰素-γ、穿孔素蛋白和T细胞或NK细胞分泌的CD107a。但复发仍是HID HSCT失败的主要原因(表1),而加强HID的靶向免疫治疗为复发预防带来了希望。
4.1改善HID HSCT后复发预测
多种模型可预测HID HSCT后复发风险(如疾病风险指数造血细胞移植特多异性合并症指数、疾病风险合并症指数)。近期Fan等人开发了一种基于人工智能的预测模型(PKU-AML模型),选择logistic回归模型作为机器学习模型,纳入5个变量(AML风险类别、首次完全缓解所需诱导化疗疗程、移植前疾病状态、移植前可测量残留病[MRD]和血型匹配)。列线图的一致性指数为0.707,Hosmer-Lemeshow检验显示该模型拟合良好(P=0.205),校准曲线接近理想的对角线,决策曲线分析显示该模型的净效益明显更好。该预测列线图的可靠性在验证队列、独立队列和临床实践中得到证实,预测HID HSCT后复发的曲线下面积和平均精确度优于现有其他模型(J Transl Intern Med 2024,已接收)。
4.2改善HID HSCT后复发预防
4.2.1预防性细胞治疗
预防性供者淋巴细胞回输(DLI)的疗效已在进展期血液恶性肿瘤患者中得到证实。Gao等人比较了使用相同CD3+ T细胞剂量(2×107 CD3+细胞/kg)的HID和MSD HSCT受者预防性DLI的结果,虽然HID HSCT受者接受免疫抑制剂治疗时间更长,但第100天的Ⅱ-Ⅳ度aGVHD率高于MSD HSCT组(59.5% vs.30.8%)。与之相反,在一项使用较低剂量CD3+细胞进行预防性DLI的研究中,即首次输注的中位剂量为0.1×106 CD3+T细胞/kg,第二次输注的中位剂量为0.5×106 CD3+T细胞/kg,DLI后第100天时II-IV度aGVHD的累积发生率仅为17%,2年复发率、NRM和无病生存率(DFS)分别为25%、15%和60%。另一项多中心研究中,单倍型相合DLI中CD3+细胞计数≥0.5×106/kg与较高的aGVHD发生率相关。尽管无法直接比较这些结果,但也提示HID HSCT后较低剂量的预防性DLI可能有助降低重度GVHD风险。
近期一项2期随机试验进一步确定了HID HSCT后供者来源NK细胞输注(DNKI)在高危髓系恶性肿瘤患者中的疗效。DNKI组患者在HSCT后第13天(DNKI-1)和第20天(DNKI-2)接受NK细胞。对于DNKI-1,给予1×108个供者NK细胞/kg,或约一半的细胞培养产物;对于DNKI-2,给予剩余的细胞培养产物。研究共纳入36例患者,第13天和第20天中位DNKI剂量分别为1.0×108/kg和1.4×108/kg。DNKI组疾病进展的累积发生率较低(35% vs 61%,P=0.040),尤其是对于原发耐药的AML患者、外周血原始细胞<5%的难治性AML患者和细胞遗传学正常/中危AML患者。DNKI和非DNKI组的30个月PFS分别为33%和11%(P=0.085)。此外,DNKI未增加GF、GVHD或感染的发生率。
4.2.2抢先干预
抢先干预已广泛用于MRD阳性患者。Mo等人发现,在ATG为基础的HID HSCT体系中,抢先DLI后的3年累积复发率、NRM和DFS分别为35.8%、10.7%和53.3%,与MSD HSCT受者相当。在EBMT报告中,PTCy为基础的HID HSCT后接受DLI的患者中,复发、NRM、DFS和OS的2年累积发生率分别为61%、17%、22%和40%。
对于接受抢先IFN-α干预的HID HSCT受者,2年MRD累积阴性率和复发率分别为82.8%和15%,2年无白血病生存(LFS)率为82.9%,均优于MSD HSCT受者。
5. HID HSCT扩展应用于霍奇金淋巴瘤
Allo-HSCT是治疗复发/难治性霍奇金淋巴瘤的潜在治愈性策略。多项研究确定了PTCy为基础的HID HSCT在这些患者中的疗效,HID HSCT可能与较低的复发率相关,PFS和OS结局与MSD-HSCT相当(表5)。然而近期一项来自EBMT数据库的报告回顾性比较了霍奇金淋巴瘤患者接受HLA全相合供者移植(96例同胞;70例非亲缘)和PTCy为基础HID HSCT患者(n=694)的结局,显示HID HSCT较HLA全相合HSCT具有更高的Ⅱ~Ⅳ度急性GVHD率(34% vs. 24%;P=0.01)和NRM率(18% vs. 10%;P=0.02),且OS率更低(70% vs. 82%;P=0.002),但两队列在复发、PFS、GRFS方面均无统计学差异。该研究提示HID和MSD HSCT治疗HL的疗效还需进一步应通过RCT证实。
6. HID HSCT扩展应用至老年患者
传统的HID HSCT预处理方案可能导致严重的器官毒性和NRM的高风险,在老年患者关中的使用仍是巨大挑战。
最近,Sun等人在一项单臂II期研究中为55-64岁患者报道了新的预处理方案,包括:阿糖胞苷(2g/m2/天),第-10和-9天;白消安(9.6mg/kg),第-8至-6天;氟达拉滨(30mg/m2/天),第-6天至第-2天;环磷酰胺(1g/m2/天),第-5天和第-4天;甲环亚胱脲(250mg/m2),第3天;兔ATG(2.5mg/kg/天,第-5天至第-2天)。移植后1年NRM和复发的累积发生率分别为23.3%和16.5%,1年OS和LFS分别为63.5和60.2%。在55-65岁的中危或高危AML患者中,接受HID HSCT作为巩固治疗的患者复发率(17.3% vs. 75.4%) 和LFS(74.0% vs. 21.6%)显著优于化疗组。
有报告认为,对于接受HID HSCT的老年血液恶性肿瘤患者,将PTCy总剂量降低至70-80mg/kg是一种安全有效的方法(表3)。Fuji等人在一项回顾性研究中比较了标准剂量PTCy(100mg/kg,n=969;中位年龄57岁)和减低剂量PTCy(80mg/kg,n=538;中位年龄61岁)的结局。倾向评分匹配后,标准剂量组和减低剂量组2年OS和NRM率分别为55.9% vs. 47.0%(P=0.36)和21.3% vs. 20.5%(P=0.55);两组aGVHD发生率也一致。
约翰霍普金斯大学小组设计了非清髓性预处理用于PTCy为基础的HID HSCT,包括环磷酰胺、氟达拉滨、2-Gy全身照射(CyFluTBI)和BM移植。GVHD和NRM的发生率均较低,使该方案成为老年患者潜在选择,但复发率可高达46%。一项回顾性多中心研究在完全缓解(CR)期接受基于PTCy HID HSCT的AML患者中比较了CyFluTBI和塞替派、降低剂量白消安和氟达拉滨(TBF)方案的疗效。在≥60岁患者中,TBF和CyFluTBI组2年LFS、OS和复发率分别为48% vs. 49%(P=0.76)、54% vs. 55%(P=0.84)和22% vs. 28%(P=0.09);在多因素分析中,CyFluTBI与NRM风险显著降低相关(HR=0.48,P=0.03)。
在美国,自2016年以来,超过20%的allo-HSCT受者年龄≥65岁,1846例年龄大于65岁的患者在2021年接受allo-HSCT。在中国,年龄超过50岁的allo-HSCT受者数量从2019年的974例增加到2021年的2950例,年龄超过60岁的allo-HSCT受者数量将从2019年的120例增加到2021年的506例,且其中67%接受HID HSCT。
7. HID HSCT扩展应用至非恶性血液疾病患者
7.1 HID HSCT用于重型再生障碍性贫血
Allo-HSCT是重型再生障碍性贫血(SAA)患者最重要的治愈方法,而HID是无MSD的SAA患者的重要替代供者。Xu等人报道了一种新的HID预处理方案(白消安3.2mg/kg/天,第-7天和第-6天;环磷酰胺50mg/kg/天,第-5天至第-2天;兔ATG2.5mg/kg/天,第-5天至第-2天)。采用该方案HID HSCT的SAA患者的无失败生存期(FFS) 无论是作为挽救治疗(HID 86.8%,MSD 80.3%)和一线治疗(HID 86.5%,MSD 88.1%)均与接受MSD HSCT的患者相当。此外,HID HSCT受者的FFS明显优于单纯接受联合免疫抑制治疗的患者(83.7% vs 38.5%),尤其是是在年龄<40岁患者。
BMT CTN 1502研究也表明,HID骨髓移植(BMT)联合减低强度预处理(兔ATG总计4.5mg/kg、环磷酰胺14.5mg/kg/d给药2天、氟达拉滨30mg/m2/d给药5天、全身照射200cGy单次给药)和PTCy预防GVHD可使复发性或难治性SAA患者获得极佳的OS(1年OS 81%)。DeZern等人开展了一项前瞻性2期试验,将减低强度预处理HID BMT和基于PTCy的GVHD预防作为SAA患者的一线治疗。27例患者的1、2和3年OS为92%;特别是采用400cGy全身照射PTCy HID HSCT的OS为100%。
严重心脏毒性是接受HID HSCT患者的早期并发症。Xu等人报告了重度心脏毒性的4个危险因素,即移植前ECOG评分高(≥2)、12导联ECG ST-T波异常、高脂血症和预处理方案中环磷酰胺校正剂量较高(≥1.8g/m2/d)。基于该模型建立了一种改良的预处理方案,包括白消安(3.2mg/kg,持续2天)、减低剂量环磷酰胺(100mg/kg)、氟达拉滨(150mg/m2)和兔ATG(10mg/kg)。与传统预处理方案(环磷酰胺200mg/kg;白消安6.4mg/kg,ATG 10mg/kg)相比,该方案可降低严重心脏毒性的发生率(2.1% vs 12.8%,P=0.032),且100天OS和FFS率相当。该优化方案使得SAA患者能更安全地接受HID HSCT。
目前HID HSCT已被推荐用于中国50岁以下SAA患者的一线治疗和51-60岁患者的二线治疗。在中国接受allo-HSCT的SAA患者中,HID比例已上升至50%以上。
7.2 HID HSCT用于遗传性疾病
镰状细胞病和β-地中海贫血是由编码β-珠蛋白基因的遗传错误引起的遗传性疾病。Allo-HSCT是这些患者最重要的治愈方法之一,但GF是HID HSCT的重要并发症。Hu等人报道,对于接受PTCy HID HSCT的输血依赖性地中海贫血患者,与低剂量环磷酰胺方案(120mg/kg)相比,高剂量环磷酰胺方案(200mg/kg)可获得更高的稳定植入率(100% vs 66.7%)、更好的OS(100% vs 88.9%)和更好的无事件生存率(95.6% vs 66.7%)。Bolaños-Meade等人报道,接受全身照射增加至400cGy方案的严重血红蛋白病患者可降低PTCy HID BMT后的GF,17例患者中分别有13例(76%)和3例(18%)达到完全和混合嵌合率,所有患者在末次随访时均存活。
范可尼贫血患者无法耐受强烈的预处理方案。Wang等人报告了适合这些患者的改良HID HSCT方案,包括60–80mg/kg环磷酰胺、150mg/m2氟达拉滨和10mg/kg兔ATG(n=15)。中位随访10.5个月时14例患者存活,12例血细胞计数恢复正常;1年DFS率为92.9%。
对于遗传性代谢病,特别是溶酶体和过氧化物酶体贮积病,Chen等人报告了改良的HID HSCT方案,包括白消安(3.2mg/kg/天,第-8至-6天)、氟达拉滨(30mg/m2/天,第-6至-4天)、环磷酰胺(50mg/kg/天,第-5至-2天)和兔ATG(2.5mg/kg/天,第-5至-2天)。末次随访时6例患者均存活。
8.联合新型免疫疗法进一步优化HID HSCT
8.1.联合新的免疫治疗改善HID HSCT的疗效
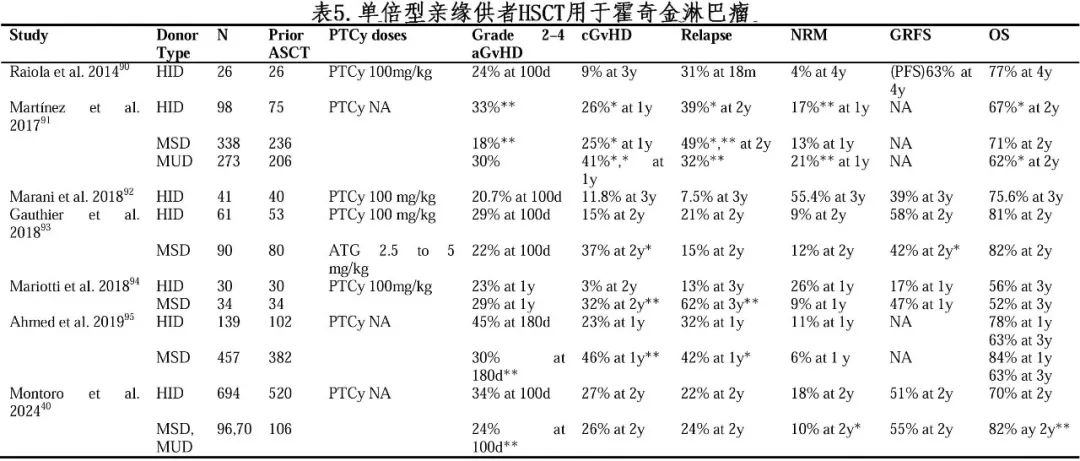
新型免疫治疗如嵌合抗原受体T (CAR-T) 细胞治疗对血液系统恶性肿瘤具有较强的靶向性,短期缓解率较高,但长期生存仍不理想。将新型免疫治疗与HID HSCT相结合可进一步改善患者长期临床预后,使得更多患者从HID HSCT中获益(图1)。
8.1.1.联合CAR-T细胞治疗
对于复发/难治性ALL,移植前CAR-T治疗有助于降低肿瘤负荷,降低移植后复发风险。Hu等人报道,在HID HSCT前接受桥接CAR-T治疗的复发/难治性B-ALL患者中,2年无事件生存、OS和复发率分别为76.0%、84.3%和19.7%。Zhao等人报道,CAR-T治疗后即使达到MRD阴性的复发/难治性B-ALL患者,接受HID HSCT仍可降低复发率(17.3% vs. 67.2%)和提高LFS率(76.1% vs. 32.8%)。
有研究报道了供者来源的CAR-T细胞治疗用于allo-HSCT后预防复发的疗效。Cheng等人报告,6例MRD阳性B-ALL患者(4例接受HID HSCT)在allo-HSCT后接受抢先CAR-T细胞治疗;5例达到MRD阴性,3例达到长期LFS。Zhao等人报告,12例allo-HSCT后MRD阳性B-ALL患者(66.7%接受HID HSCT)接受抢先CAR-T细胞治疗,均达到MRD阴性。与同期接受抢先DLI的患者相比,接受抢先CAR-T细胞治疗的患者复发率显著更低、LFS显著更优。
此外Chen等人报道,6例allo-HSCT后出现复发的患者接受供者来源CAR-T细胞治疗,5例获得MRD阴性CR(83.3%),但4例患者在CAR-T细胞治疗后2-7个月再次出现复发。在一项更大样本的延伸研究中,34例allo-HSCT后复发的B-ALL患者(22例接受HID HSCT)接受供者来源CAR-T治疗,30例获得MRD阴性CR;但获得CR者的18个月OS率仅为30%。中位随访12.7个月时,17例患者复发。可见移植后复发患者CAR-T细胞治疗的长期生存仍不能令人满意。
8.1.2.联合双特异性T细胞衔接抗体
贝林妥欧单抗可用于复发/难治性B-ALL患者HID HSCT前后治疗。Wu等人报道了4例HID HSCT后HLA丢失的复发患者接受贝林妥欧单抗治疗后均获得CR,3例达到MRD阴性。然而在HID HSCT前后接受奥加伊妥珠单抗治疗的患者中,应注意其特殊的副作用,即肝窦阻塞综合征,治疗后的发生率可达29%。
8.2.联合新的免疫疗法可提高HID HSCT安全性。
8.2.1联合病毒特异性细胞毒性T细胞
巨细胞病毒(CMV)感染(特别是难治性/复发性感染)可显著增加HID HSCT后NRM风险。Zhao等人报告用CMV特异性细胞毒性T细胞(CTL)可促进移植物来源的内源性CMV特异性免疫的重建,有效减少体内CMV感染。此外,CMV特异性CTL的一线治疗促进了患者CTL的数量和功能恢复,有助CMV清除。最近,Pei等人报道CMV-CTL过继治疗HID HSCT后CMV感染的安全性和有效性,首次CMV-CTL输注后第1、4、6周累积完全缓解率分别为37.9%、76.8%、89.5%;在CTL输注后达到完全缓解的患者中,62.7%在随访期间未出现CMV复发。
8.2.2联合间充质干细胞
为了进一步降低cGVHD的风险,Gao等人在一项多中心、双盲RCT(ChiCTR-IOR-15006330)中探讨了使用间充质干细胞(MSC)预防HID HSCT后GVHD的有效性和安全性。随机将患者分入移植后接受脐带来源MSC预防(MSC组;3×107个细胞/100mL/月)或生理盐水(非MSC组;100mL/月)治疗>4个月。MSC组cGVHD的2年累积发生率为27.4%,明显低于非MSC组(49.0%,P=0.021)。近期Huang等人开展一项多中心开放标签RCT研究(ChiCTR-IIR-16007806),评价了HID HSCT后早期(移植后45天开始)重复输注脐带来源MSC的疗效,MSC组重度cGVHD、Ⅱ~Ⅳ度aGVHD发生率低于对照组,GRFS率也更优。
9.总结和展望
综上所述,随着对移植后关键并发症防治方法的优化,HID HSCT已经可以广泛应用于根治血液系统恶性肿瘤或血液系统良性疾病,HID也已成为最重要的替代供者。新型免疫治疗的快速发展也有助于进一步提高HID HSCT的疗效和安全性。
但HID HSCT未来仍有巨大提升空间,例如GVHD仍是HID HSCT后的重要并发症,明确HID HSCT后免疫耐受机制有助进一步预防GVHD。病毒感染是HID HSCT失败的主要原因,促进免疫重建的新策略,特别是开发通用型病毒CTL,有助进一步预防HID HSCT后重度病毒感染。最后,新型靶向药物和细胞治疗可以帮助难治/复发血液恶性肿瘤患者实现疾病缓解并获得更好的HID HSCT机会,借助HID HSCT的长期疾病控制能力,这些患者终将实现持久的DFS。
参考文献
Xiaodong Mo, Xuying Pei, and Xiaojun Huang. Optimization of T-cell replete haploidentical hematopoietic stem cell transplantation: the Chinese experience.Haematologica. 2024 Nov 21. doi: 10.3324/haematol.2024.286194
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#造血干细胞移植# #HID HSCT#
23