Nat Med:AAV递送RNAi治疗共济失调惊现脑毒性
2021-10-23 haibei MedSci原创
遗憾的是,在AAV.miS1递送到小脑深部核团后,研究人员意外地观察到小脑毒性。
多聚谷氨酰胺(PolyQ)疾病是由不同基因编码区的CAG重复序列的异常扩展引起的。针对PolyQ疾病的功能增益毒性的一个共同治疗策略是抑制或沉默突变基因或基因产物的表达。其中一种方法是使用腺相关病毒(AAV),通过RNAi递送针对突变基因的序列。目前,这种方法已经在进行亨廷顿病的早期临床试验(NCT04120493),并且正在朝其他多基因疾病的临床1期试验接近,如脊髓小脑共济失调1型(SCA1)。

SCA1是一种成年发病的神经退行性疾病,由Ataxin-1(ATXN1)基因编码区的CAG扩展引起。在SCA1患者中,大于40个重复序列的纯CAG扩增通过蛋白质功能增益机制引发蛋白质聚集、转录失调和细胞毒性,从而导致疾病。虽然ATXN1的表达无处不在,但神经变性主要发生在小脑浦肯野细胞(PC)和脑干核团。SCA1的临床症状包括步态和肢体共济失调、眼球震颤、吞咽困难和语言异常等。
已有的研究数据显示,用于治疗脊髓小脑共济失调1型的干扰RNA(RNAi)可以预防和逆转小鼠模型中的行为缺陷和神经病理学读数,其安全性和益处可以持续好几个月。由腺相关病毒载体(AAV.miS1)表达的RNAi触发器还能纠正错误的微RNA(miRNA),如miR150。随后,研究人员还表明,这种传递方法是可扩展的,而且AAV.miS1在短期试点非人类灵长类动物(NHP)研究中是安全的。
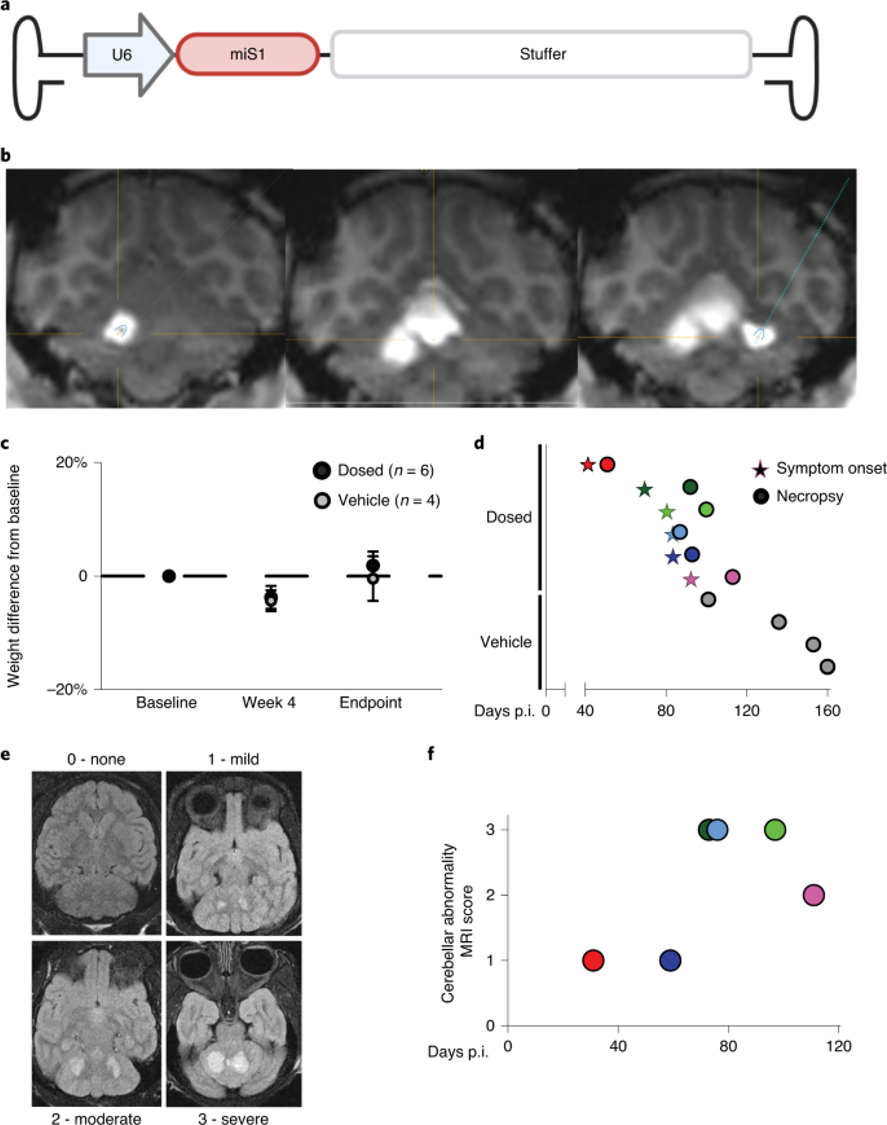
AAV.miS1递送到NHP脑部导致神经系统缺陷。
为了将该技术推广到患者身上,研究人员启动了对非人灵长类动物的新药研究(IND)。遗憾的是,在AAV.miS1递送到小脑深部核团后,研究人员意外地观察到小脑毒性。小RNA-seq和使用不含miRNA的AAVs的研究都表明,这不是内源性miRNA处理机制饱和的结果。
RNA-seq和AAV产品的测序显示,尽管交叉包装的材料数量有限,但仍有大量的倒置末端重复(ITR)启动子活性,与神经病变相关联。ITR启动子的活性通过改变miS1的表达环境而降低。
因此,这项啮齿动物和NHP研究结果之间的惊人对比突出表明,在评估用于人类的新疗法时,需要在多个物种中进行扩展的安全性研究。
原始出处:
Megan S. Keiser et al. Toxicity after AAV delivery of RNAi expression constructs into nonhuman primate brain. Nature Medicine (2021).

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Nat#
72
#RNAi#
83
#脑毒性#
75
#AAV#
67
#Med#
81
学习学习
89