一次性使用医疗器械能否复用?看世界各国如何做
2017-03-24 胡杨 SIFIC感染官微
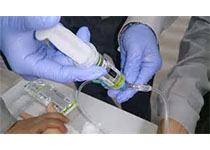
复用SUD有发生感染和性能破坏的风险,但巨大的经济利益导致复用有存在的空间。能否复用应该以不丧失安全性和有效性为标准,政策上“堵或放”两个极端都是不明智的。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










学习了,我国可以借鉴
95
学习了
102