4天!中国医学科学院刘芝华等团队在Nature子刊/STTT/Cell子刊发表3项研究成果
2022-10-27 iNature iNature
在研究数据中,简单的TD和TSI相关的重排都显示出监管区域的低拷贝数增益。除了公认的基因KLF5和MYC,还提名了一个基因PTHLH,它主要由超增强子扩增驱动。
2022年10月22日,中国医学科学院詹启敏、刘芝华和山西医科大学崔永萍共同通讯在Nature Communications 发表题为“Characterization of somatic structural variations in 528 Chinese individuals with Esophageal squamous cell carcinoma”的研究论文,该研究分析了528个全基因组,以研究结构变异的机制和生物学功能。SV在大小上显示出多模式分布,表明不同的突变过程。研究者开发了一个工具并定义了五种类型的带有模板插入的复杂重排,强调了一种与不良结果相关的折回倒置。
不同的重排特征展示了可变的基因组指标,具体来说,折返倒置往往发生在中心体附近。通过功能实验证实了PTHLH基因的致癌作用及其与增强子的相互作用。最后,染色体外环状DNA(ecDNA)存在于14%的ESCC中,并且对驱动基因具有很强的选择性优势。
另外,2022年10月25日,中国医学科学院/北京协和医学院刘芝华团队在Cell Reports 发表了来自题为“OTUB2 exerts tumor-suppressive roles via STAT1-mediated CALML3 activation and increased phosphatidylserine synthesis”的研究论文,该研究揭示了去泛素化酶OTUB2在舌及食管鳞状细胞癌中的重要抑癌功能,并发现该功能是通过促进转录因子STAT1的磷酸化及二聚体形成而实现的。通过代谢组学研究,该研究发现磷脂酰丝氨酸合成增加是介导OTUB2抑癌功能的关键代谢事件,并且临床前研究结果提示经口服用磷脂酰丝氨酸可能会为抑制舌及食管鳞状细胞癌的发生发展带来帮助。
2022年10月24日,中国医学科学院北京协和医学院刘芝华及北京大学吴楠共同通讯在Signal Transduction and Targeted Therapy(IF=38)在线发表题为“Dysregulated ceramides metabolism by fatty acid 2-hydroxylase exposes a metabolic vulnerability to target cancer metastasis”的研究论文,该研究表明脂肪酸2-羟化酶引起的神经酰胺代谢失调暴露出靶向癌症转移的代谢脆弱性TNFα-FOXC2-FA2H是一种新的促进转移的信号轴,其下游产物二氢神经酰胺可能是一种有前景的干预转移的药物。

食管癌是最具侵袭性的癌症之一,食管鳞状细胞癌(ESCC)是主要的病理类型。了解遗传基础和潜在的突变机制对于药物开发和临床治疗至关重要。在过去的十年中,研究人员从不同的人群、多区域测序和组学整合分析等各个方面描述了ESCC的遗传景观。这些研究基于基因组测序,探索了ESCC肿瘤发生过程中的驱动突变、突变过程、关键途径或克隆动力学。他们发现了诸如NOTCH1、ZNF750和NFE2L2等反复突变的基因,以及与饮酒相关的突变过程。然而,很少有人进行全基因组测序,关于SV及其机制的分析仍然有限。
SV是导致基因组片段重复、缺失或倒位的基因组重排。在这项研究中,将涉及两个或多个SV的事件称为复杂重排。相比之下,简单的重排只涉及一个SV。每个SV由两个断点组成,分为五种类型:删除型(+/-)、TD-型(-/+)、头对头(+/+)、尾对尾(-−)类型和易位。不同大小的缺失和TD似乎来自不同的突变过程,并在人类癌症中显示出可变的功能特性。最近,提出了带有模板插入的复杂重排,它们通常由来自不同基因组区域的几个模板副本组成。模板化插入在肝癌中反复激活TERT 然而,结构变异的模式及其在ESCC中的患病率并未完全揭示。这些模式在ESCC中的临床意义尚不清楚,由不同突变过程形成的驱动基因在很大程度上仍然未知。
为了表征ESCC中的体细胞重排及其基因组和临床意义,研究者根据SV的大小和重排模式对SV特征进行解码。开发了一种基于图的方法来查找和分类复杂的重排。断点被视为图节点,同一SV的两个断点或两个相邻的具有适当方向的断点分别被视为断点边和序列边。结合断点和边缘的覆盖,可以提取ESCC中潜在的重排模式。
在这项研究中,分析了528个配对基因组,以研究潜在的SV模式及其在ESCC中的临床意义。定义了几种在ESCC中普遍存在的复杂重排类型,其中强调了一种与不良结果相关的折回倒置。进一步探索了不同SV类型的突变过程,并揭示了它们与基因组指标的关联。还确定了由TD-c2特征驱动的PTHLH基因的超增强子中的一个热点。最后,报告了导致癌基因高水平扩增的TD和ecDNA的不同模型。
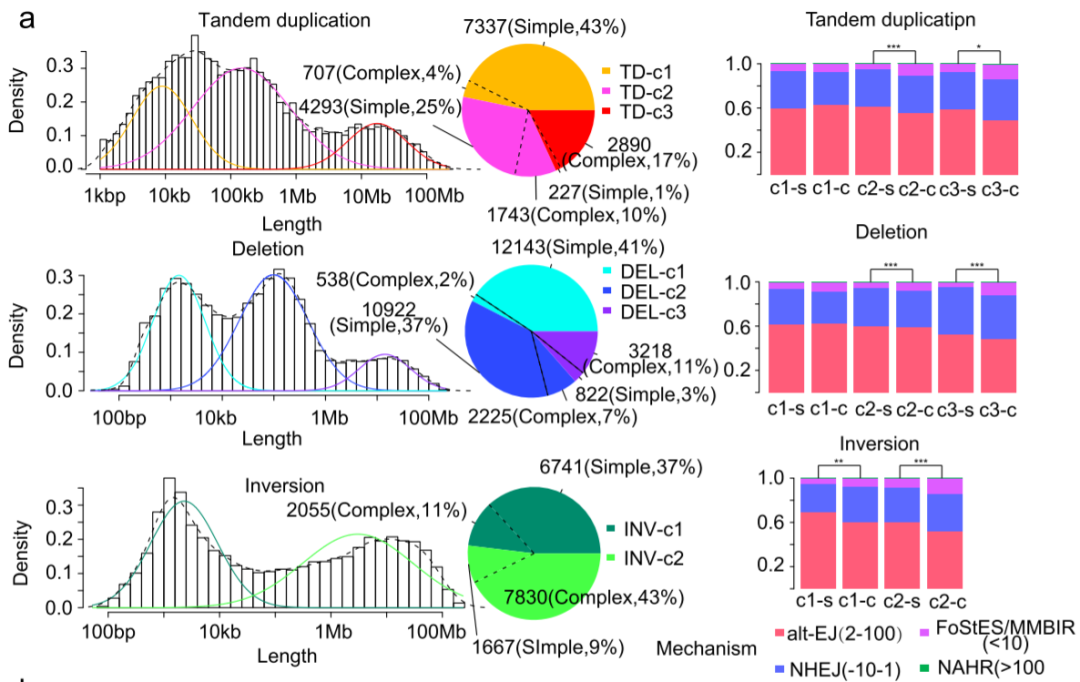
ESCC中的结构变异特征(图源自Nature Communications )
最后,在研究数据中,简单的TD和TSI相关的重排都显示出监管区域的低拷贝数增益。除了公认的基因KLF5和MYC,还提名了一个基因PTHLH,它主要由超增强子扩增驱动。以往的ESCC研究主要集中在编码区,而调控部分似乎是ESCC研究的新领域。
参考消息:
https://doi.org/10.1038/s41467-022-33994-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言