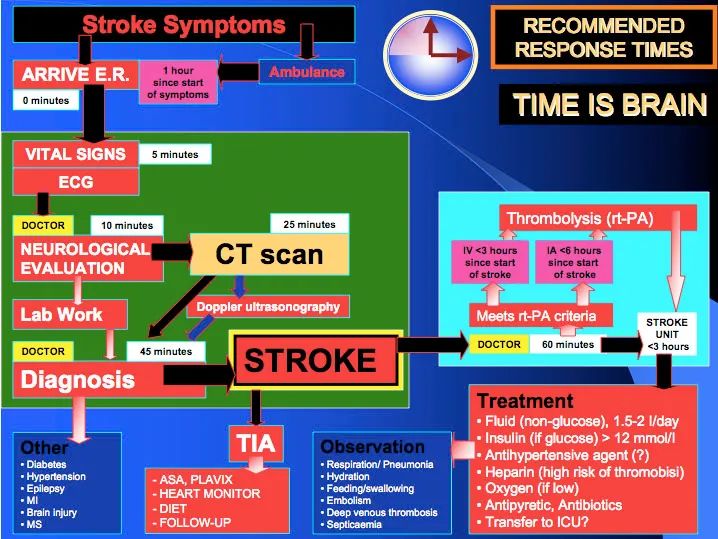
隐源性缺血性卒中(CIS)|临床实践
2023-04-10 神经科学论坛 网络 发表于上海
文章介绍了CIS定义、PFO作为CIS病因、PFO生理结构、诊断及RLS量化,从病变大小、累及血管区域、分布、病变数量
1.隐源性缺血性卒中
1.1何谓CIS
在20%~40%的缺血性卒中患者中,尽管进行了广泛的评估,但仍未确定明确的病因,这种情况被定义为“隐源性缺血性卒中(CIS)”。但Stone等认为它是一种排除诊断,想要诊断CIS需要排除其他原因,其中一条是排除高风险的心源性栓子(高风险的心源性栓子包括:来源于心房颤动、心房扑动、心脏血栓、假体瓣膜、心脏肿瘤、近4w内的心肌梗死、二尖瓣狭窄、左心室射血分数<30%、瓣膜赘生物或感染性心内膜炎的栓子)。目前CIS发生机制尚不明确,而Stone等发现许多被认为“低风险”的致CIS机制,其中PFO诱导的矛盾栓塞是上述机制之一。Amatangelo等认为PFO为中度风险的心源性栓子。因此,根据上述报道将PFO诱导RLS的卒中患者仍归类为CIS。
1.2PFO作为CIS病因
Nagarajarao等发现在大多数情况下,PFO的存在是没有临床意义的,但在某些血流动力学条件下会引起RLS,导致血栓栓塞事件。已知诱导RLS原因包括:卵圆孔未闭(PFO)、房间隔缺损、室间隔缺损和肺动静脉瘘等,而PFO是RLS最常见的致病因素。长期以来,PFO一直被认为是CIS患者的重要病因,其诱导的右至左分流产生矛盾性栓塞被认为是CIS的重要发病机制。
2.卵圆孔未闭
2.1PFO生理结构
卵圆孔是心脏房间隔胚胎时期的一个生理性通道,出生后5~7m左右,大多数人房间隔的原发隔和继发隔相互黏连、融合形成永久性房间隔,若没有融合则形成卵圆孔未闭(PFO)。约25%~34%的成年人卵圆窝部两层隔膜未完全融合,中间遗留一个永久性的裂缝样缺损。根据未闭卵圆孔直径大小,通常将卵圆孔未闭分为:
-
(1)大卵圆孔未闭(≥4.0mm);
-
(2)中卵圆孔未闭(2.0~3.9mm);
-
(3)小卵圆孔未闭(≤1.9mm)。
近年来发现,PFO患者发生脑卒中、偏头痛、外周动脉栓塞等风险较正常人群呈倍数升高。
2.2PFO诊断
目前还没有公认的诊断PFO标准,其诊断通常是结合经胸超声心动图(transthoracic echo cardiogram,TTE)、经食管超声心动图(transesophageal echo cardiogram,TEE)和经颅多普勒(transcranial Doppler,TCD)的检查结果,很多人选择后者。TTE通常是一种非侵入性检测PFO的方法,其特异性为99%,敏感性为46%。鉴于TTE的敏感性较低,对PFO高度怀疑且TTE检查为阴性的患者检测往往需要TEE检查,它具有更好的敏感性(89%)和特异性(92%),并提供了其潜在相关的结构特征,如房间隔动脉瘤、卵圆孔移动性、长度和隔膜厚度。
尽管TEE在检查心脏结构方面提供了更好的可视化,但TCD检测栓塞已被证明比TEE(96%)更敏感,并且与TTE或TEE一样特异。TCD检测(发泡试验)是由搅拌的盐水气泡在3个心脏周期内分流到左心房的数目决定,通常是通过Valsalva动作来激发气泡,以提高右心房的压力,发现PFO是否存在右至左分流,引起动脉微栓子经过。
2.3RLS量化方法
在以往研究中,将9ml生理盐水、1毫升空气和一滴患者的血液在两个10ml注射器之间充分混合,两个注射器之间由一个三通旋塞链接。用血滴延长空气微栓子在血液中的悬浮时间,提高检测微栓子信号(micro-embolisignal,MES)的敏感性。在正常呼吸和Valsalva动作开始前5s时,迅速将溶液注入肘前静脉,通过计数注射溶液后前25s观察到的大脑中动脉MES的数目来量化RLS。根据MES的数目分为以下三组:非RLS:无MES;轻度RLS:≤25MES;重度RLS:>25MES。为了区分TCD检测到的心内和肺内分流所致RLS,当检测到超过10个MES时,进行TEE。
对所有患者进行TTE检查,排除其他可诱发RLS的疾病,如房间隔动脉瘤、持续性咽鼓瓣、房间隔缺损和紫绀型先天性心脏缺损。此外,如果怀疑有肺动静脉畸形等肺内分流疾病,患者可能需行肺动脉CTA检查。
3.不同量RLS的CIS患者影像学特征
由PFO引起的右至左分流会增加CIS风险,但大家对RLS数量与CIS模式之间的关系知之甚少。很少有研究评估RLS患者影像学病变模式,也没有确定缺血性病变模式与RLS的存在和数量之间的关系。随着检查设备的敏感性及诊疗技术水平的提高,后期有很多研究者们把焦点放在了此方面,为了更好分析合并RLS的CIS影像学特征,Thaler等在其研究中将缺血性病变首先按病变数目分为单病变和多病变;因病变位置不同,分为皮质、皮质下和深部白质病变。
Kim等根据病变大小分为小病变(梗死直径≤1cm)、大病变(梗死直径>1cm)和大面积梗死(梗死直径>3cm,或至少涉及2个主血管区解剖部位)。Kang等根据病变所涉及的血管区域,将梗死灶分为前循环、后循环、前后循环、双侧前循环和多个循环。近些年来大量研究共同显示该类患者的影像学特点是:数量越多的RLS患者梗死灶多集中于后循环,会出现较多的小病变、多皮质病变,且病变数目也会随之增加。
3.1病变大小
大量研究显示因PFO诱导的RLS数量越多,小病变梗死灶越多。2013年Kim等通过研究发现MRI弥散加权成像(Diffusion-weighted imaging,DWI)中RLS越多,小病变梗死灶越多,他们认为RLS数量决定了DWI病变模式。后Huang等发现多发性小缺血病变与CIS患者合并RLS显著相关。同时He等也发现RLS数量越多的患者,其影像学上表现为更多的小病变梗死灶。Nam等研究也描述了这一观点。当然还有很多研究对此特征产生的原因进行了阐述,分析如下:Huang等认为这可能是由PFO病灶的解剖结构决定,它作为“不大的”过滤器,只允许小的栓子通过。
在Kim研究中PFO被认为是栓子从静脉系统进入脑循环的通道,一般只能让较小的栓子通过,如果RLS增加,通过PFO小栓子的数目可以相对增加,此研究还表明,TEE测量PFO大小与TCD检测到RLS量呈正相关。Telman等也证实PFO越大,微泡数目越多。但是,也有其他学者提出了不同观点,当PFO合并其他疾病时影像学显示梗死面积较大。
2006年Santamarina等第一次根据心脏间隔异常分析CIS患者DWI异常模式,发现在没有PFO、仅有PFO及PFO合并房间隔动脉瘤(Atrial septal aneurysm,ASA),三组患者中它们梗死模式存在差异。在DWI上检测到大的皮质下区域梗死与PFO合并ASA的存在独立相关,而与右至左分流的程度无关。同期Bonati等首次通过DWI表现评估PFO卒中栓塞性脑损伤,结果显示与单纯PFO相比,PFO合并ASA更容易发生多种面积较大的缺血性病变,而PFO的大小和RLS的程度与DWI病变特征无显著性差异。
随着后期人们对PFO逐步认识,在2010年Akhondi等通过分析卒中患者MRI首次发现间隔偏移距离与梗死灶体积之间存在显著的相关性。Lee、Halperin等提出PFO并不仅仅是通过矛盾性栓塞来解释缺血性脑卒中事件,PFO本身也能改变心脏结构,特别是左心房功能障碍。的确,大量研究表明ASA和阵发性心房颤动常伴有PFO,在这些患者中,扩大的心房的瘀血使大的血栓无法穿过PFO病变。这种大的血栓可以系统地通过左心室移动到颅内动脉,因此病变表现为面积较大的梗死。
总而言之,PFO相关的CIS梗死面积较大的病变更有可能与房间隔动脉瘤的存在、间隔偏移距离、静脉血栓形成和凝血障碍等有关,但与PFO的大小或RLS程度没有明显联系。
3.2后循环优势
后循环又称椎基底动脉系统,由椎动脉、基底动脉、大脑后动脉组成,主要供血给脑干、小脑、丘脑、枕叶、部分颞叶及上段脊髓。He等研究显示当PFO诱导的RLS量增加时,病变更有可能集中于后循环。Kim等发现PFO相关卒中在影像学上可能表现为更多的集中于椎基底动脉循环。早在2001年Hayashida等研究中已经证明,在患者做Valsalva动作时,通过使用放射性核素静脉造影方法显示发现后循环的血流量显著超过PFO患者的前循环,这可能是由于在做Valsalva动作过程中,后循环对交感神经刺激的敏感性较低,导致大量RLS进入后循环。
Yasaka等发现通过PFO的小栓子可能比颈总动脉的血栓更容易进入椎动脉。早在1998年Steiner等发现在他的研究里所有卒中患者中,较大的PFO与后循环的大的、浅表的病变有关。但是有很多研究者提出了相反的观点,如Nam等研究中未观察到PFO相关卒中后循环受累的优势。Huang等发现多发性小缺血病变及皮质下额顶叶梗死病变与CIS患者合并PFO显著相关。Stecco等除了发现后循环发病率较高之外,也发现多个循环梗死的患病率也很高(32.8%),但这种模式的缺血在PFO组的原因尚不清楚。
3.3皮质病变
Stecco等通过回顾性研究,比较PFO相关脑卒中和心房颤动相关脑卒中(AF-卒中)患者的特异性缺血性病变分布模式,结果表明PFO相关卒中主要累及皮质,而AF-卒中主要累及皮质下区域。Nam等研究评估100例CIS患者,其中59例患者发现有PFO,且大量RLS表现为皮质病变增多。此外,很多研究中将累及大脑或小脑皮质的病变统称为浅表层病变。多个数据库已经将梗死部位定义为浅层、深层或两者兼而有之,或皮质、皮质下或两者兼而有之。
在RoPE研究中,被描述为上述两者的梗死被认为是浅表。深部大脑中动脉边界带被认为是深部的,而大脑中动脉/大脑前动脉和大脑中动脉/大脑后动脉边界带被认为是浅表的。Steiner等通过对比较大量RLS组和小量RLS组或无RLS组,发现浅表梗死发生在大量RLS组。
3.4病灶数量
如前所述,如果RLS增加,通过PFO的小栓子数目可以相对增加,病变数量也相应增加。Kim等研究发现大量RLS患者的DWI上会出现较多病变数量。Nam等也发现大量RLS与DWI病变的数量呈正相关。
4.小结
综上所述,文章介绍了CIS定义、PFO作为CIS病因、PFO生理结构、诊断及RLS量化,从病变大小、累及血管区域、分布、病变数量4方面分析隐源性缺血性卒中患者的影像学特征具有以下特点:数量越多的RLS患者梗死灶多集中于后循环,会出现较多的小病变、多皮质病变,且病变数目也会随之增加。
来源:许云云,何治君,张雪梅.右至左分流隐源性缺血性卒中的影像学研究进展[J].中风与神经疾病杂志,2020,37(05):474-476.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







多
74