J Hepatol:辉瑞mRNA新冠疫苗可能引发一种罕见的以T细胞为介导的自身免疫性肝炎
2022-04-27 药圈涛哥 生物药大时代
梅斯医学提示:这与目前在多国发生的小儿急性肝炎关系不大。下面两例均为成人。
梅斯医学提示:这与目前在多国发生的小儿急性肝炎关系不大。下面两例均为成人。
德国的最新临床研究发现,辉瑞/BioNTech联合开发的新冠mRNA疫苗(BNT162b2)可能引发一种罕见的以T细胞为介导的自身免疫性肝炎。
4月20日,《SARS-CoV-2 vaccination can elicit a CD8 T-cell dominant hepatitis》刊发于肝病领域国际权威期刊《肝病学杂志》(Journal of Hepatology)上,作者单位包括德国弗莱堡大学医学院、德国慕尼黑工业大学医学院病理研究所、德国癌症协会等。

自身免疫肝炎是由自身免疫反应介导的慢性进行性肝脏炎症性疾病,其临床特征为不同程度的血清转氨酶升高、高γ-球蛋白血症、自身抗体阳性,组织学特征为以淋巴细胞、浆细胞浸润为主的界面性肝炎,严重病例可快速进展为肝硬化和肝衰竭。
相比于灭活疫苗等传统技术平台开发的疫苗,mRNA疫苗则是在COVID-19大流行中才完成“首秀”,全球科学界仍在持续研究其在真实世界中的表现。来自德国的这项临床研究披露了一起接种2剂辉瑞mRNA疫苗出现的急性肝炎的双峰发作(两次接种后均发作)。这名男性患者今年52岁,除甲状腺功能减退外无其他病史。
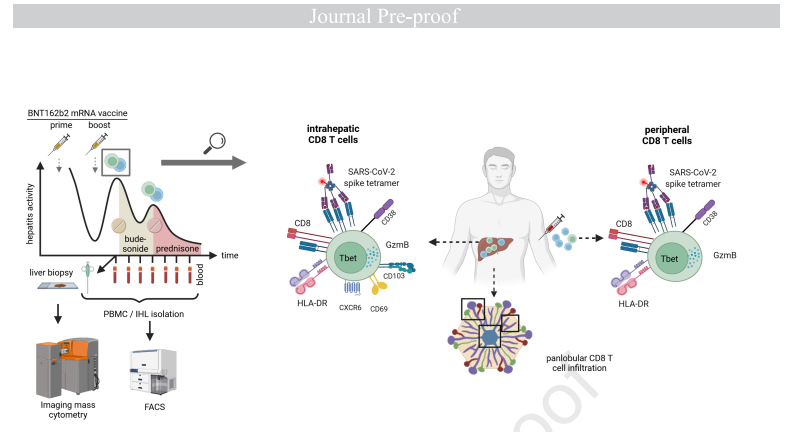
背景与目标:在SARS-CoV-2感染和疫苗接种后已经描述了自身免疫性肝炎发作,但其病理生理学仍不清楚。在这里,我们报告了一名52岁男性的病例,表现为急性肝炎的双峰发作,每次发生在 BNT162b2 mRNA 疫苗接种后2-3 周,并试图确定潜在的免疫相关性。患者首次口服布地奈德,复发,但在全身性类固醇下达到缓解。
方法:对肝活检组织进行了用于空间免疫分析的成像质谱流式细胞术。进行流式细胞术以剖析 CD8 T 细胞表型并纵向识别 SARS-CoV-2 特异性和 EBV 特异性 T 细胞。通过ELISA确定疫苗诱导的抗体。数据与临床实验室相关。
患者样本:
在德国弗莱堡大学医学中心招募了一名52 岁男性和 3 名医护人员(均为 HLA-A*03:01,经 NGS 证实)在加强疫苗接种后 26 天以上接受了 mRNA 疫苗 BNT162b2。所有参与者都获得了书面知情同意书。此外,从弗莱堡外科病理学研究所获得了来自健康肝组织(结直肠癌肝转移-远处组织)的5个样本。该研究是根据联邦指南和当地伦理委员会规定(德国弗莱堡阿尔伯特路德维希大学)
结果:对肝组织的分析显示,免疫浸润在数量上由具有泛小叶分布的活化细胞毒性 CD8 T 细胞主导。与对照相比,还观察到 CD4 T 细胞、B 细胞、浆细胞和骨髓细胞的富集。与外周血相比,肝内浸润显示出具有 SARS-CoV-2 特异性的 CD8 T 细胞富集。值得注意的是,肝炎的严重程度与外周 SARS-CoV-2 特异性的活化细胞毒性表型纵向相关,但与 EBV 特异性 CD8+ T 细胞或疫苗诱导的免疫球蛋白无关。
结论:
COVID19 疫苗接种可引发一种独特的 T 细胞显性免疫介导的肝炎,其独特的发病机制与疫苗接种诱导的抗原特异性组织驻留免疫相关,需要全身免疫抑制。
总结:
在 SARS-CoV-2 感染期间观察到肝脏炎症,但也可能在某些人接种疫苗后发生,并且与自身免疫性肝病具有一些典型特征。在本报告中,我们表明高度活化的 T 细胞在 SARS-CoV-2 疫苗接种后肝脏炎症患者的肝脏不同区域积聚并均匀分布。此外,在这些肝脏浸润性 T 细胞中,我们观察到对 SARS-CoV-2 有反应性的 T 细胞富集,这表明这些疫苗诱导的细胞在这种情况下可能导致肝脏炎症。
具体研究情况:
在本研究中,研究人员描述了一名男性在第一次 BNT162b2 疫苗接种后出现急性混合性肝炎和第二次接种后出现严重肝炎的病例。
患者年龄 52 岁,除甲状腺功能减退外无其他病史,并出现恶心、瘙痒、食欲不振和乏力。第一次 BNT162b2 给药后约 10 天出现症状。随后,患者出现黄疸,肝功能检查 (LFT) 显示为急性混合性肝细胞/胆汁淤积性肝炎,并在首次接种疫苗 25 天后入住初级保健中心。
根据血清学或聚合酶链反应 (PCR) 测试,排除了甲型、乙型、丙型或戊型肝炎病毒、巨细胞病毒 (CMV) 和 Epstein-Barr 病毒感染的原因。第一次接种后 41 天,患者接种了第二次 BNT162b2 疫苗,第二次接种后 20 天,患者出现疲劳和恶心。实验室检测证实急性混合性肝炎复发,第二次接种后26天,病例被转至三级医疗中心。在随后的几周内,肝酶水平下降,并且在开始治疗 39 天后发生了另一次复发,由全身性类固醇和熊去氧胆酸控制。LFT 在八周内恢复正常,抗尖峰 (S) 抗体没有显示出显着波动。
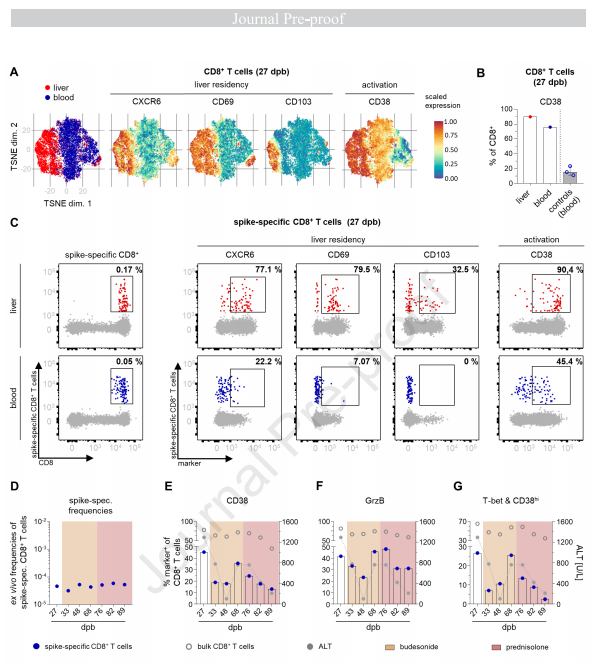 此外,研究小组还在肝脏中发现了 T 和 B 淋巴细胞、巨噬细胞、粒细胞和浆细胞的浸润。相对于对照(未患病)组织,观察到免疫细胞增加了 5.3 倍。分化 8 (CD8) T 淋巴细胞簇是免疫细胞中最丰富的,这是 AIH 未预料到的情况。相比之下,与典型的 AIH 表现不同,B 细胞和浆细胞相对较低,尽管比对照更丰富。对不同免疫细胞亚群的肝实质的空间分析揭示了门静脉周围区域更广泛的免疫浸润。虽然 B 细胞和浆细胞主要在门静脉周围区域富集,但 CD8 T 淋巴细胞呈全小叶分布。值得注意的是,细胞毒性 CD8 T 细胞(以颗粒酶 B 为特征)高度积累,而其他表达颗粒酶 B 的细胞的水平保持不变。
此外,研究小组还在肝脏中发现了 T 和 B 淋巴细胞、巨噬细胞、粒细胞和浆细胞的浸润。相对于对照(未患病)组织,观察到免疫细胞增加了 5.3 倍。分化 8 (CD8) T 淋巴细胞簇是免疫细胞中最丰富的,这是 AIH 未预料到的情况。相比之下,与典型的 AIH 表现不同,B 细胞和浆细胞相对较低,尽管比对照更丰富。对不同免疫细胞亚群的肝实质的空间分析揭示了门静脉周围区域更广泛的免疫浸润。虽然 B 细胞和浆细胞主要在门静脉周围区域富集,但 CD8 T 淋巴细胞呈全小叶分布。值得注意的是,细胞毒性 CD8 T 细胞(以颗粒酶 B 为特征)高度积累,而其他表达颗粒酶 B 的细胞的水平保持不变。
接下来,流式细胞术深入分析了 CD8 T 细胞的肝内和外周种群。肝内 CD8 T 细胞池显示激活标志物 (CD38) 和组织驻留标志物 (CD103、CD69 和 CXC 基序趋化因子受体 6 [CXCR6]) 的富集。外周血中的 CD8 T 细胞也表达 CD38。有趣的是,在疫苗接种后没有发生肝炎的情况下,患者 (75.9%) 的 CD38 表达明显高于对照组 (15.4%)。与外周血相比,肝内 CD8 T 细胞群中的 SARS-CoV-2 S 特异性 CD8 T 淋巴细胞富集 3.4 倍。
此外,外周血中 S 特异性 CD8 T 淋巴细胞的丰度是 Epstein-Barr 病毒特异性 T 细胞对照表位特异性 T 淋巴细胞的 10.2 倍。注意到循环中 S 特异性 CD8 T 细胞的频率稳定,并且 CD38 水平随着布地奈德治疗而降低。然而,当布地奈德治疗期间发生复发时,SARS-CoV-2 S 蛋白和其他细胞毒性标志物特异性 CD8 T 细胞上的 CD38 表达升高,但在用全身免疫抑制剂治疗后恢复正常。
结论:研究人员注意到外周免疫球蛋白和血浆和 B 细胞的肝内富集略有增加。引人注目的是,细胞毒性 CD8 T 细胞(表达 CD38)是最丰富的,因为它们是肝脏中最丰富的免疫细胞。这些观察结果将 T 细胞作为与疫苗相关免疫性肝炎相关的致病细胞类型作为新的 AIH 亚型。这些发现表明,接种 BNT162b2 疫苗可能通过疫苗引发的细胞免疫机制引起免疫介导的肝炎。
关于此类研究在2021 年 10 月 26 日也有一篇文章:报告了一例 65 岁女性,她在接种第一剂 Moderna-COVID-19 疫苗两周后出现急性重症自身免疫性肝炎。

mRNA疫苗属于“首秀”,全球科学界仍在持续研究其在真实世界中的表现,承认副作用,承认不足,才是正确对待科学的态度。
参考资料:
https://www.news-medical.net/news/20220425/COVID-19-vaccine-can-elicit-a-distinct-T-cell-dominant-immune-mediated-hepatitis.aspx
https://www.journal-of-hepatology.eu/article/S0168-8278(22)00234-3/fulltext
https://pubmed.ncbi.nlm.nih.gov/34717185/
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#EPA#
103
#罕见#
103
与阴谋论无关吧
125