Nat Cell Bio:广州生物院发现细胞“返老还童”新机制
2013-05-28 Nat Cell Bio 广州生物医药与健康研究院
诱导多能干细胞技术可以将普通的体细胞重编程为具有与胚胎干细胞类似的分化潜能的细胞,也就是说获得的诱导多能干细胞具有分化成为体内绝大多数种类细胞的能力。与这一技术密切相关的细胞移植也已经被认为是治疗部分遗传病,器官损伤以及神经退行性疾病等的重要潜在手段。而建立该技术的科学家也凭此获得了2012年度诺贝尔生理或医学奖。为了更好更快地将这一技术应用到疾病治疗中,中国科学院广州生物医药与健康研究院一直致力
诱导多能干细胞技术可以将普通的体细胞重编程为具有与胚胎干细胞类似的分化潜能的细胞,也就是说获得的诱导多能干细胞具有分化成为体内绝大多数种类细胞的能力。与这一技术密切相关的细胞移植也已经被认为是治疗部分遗传病,器官损伤以及神经退行性疾病等的重要潜在手段。而建立该技术的科学家也凭此获得了2012年度诺贝尔生理或医学奖。为了更好更快地将这一技术应用到疾病治疗中,中国科学院广州生物医药与健康研究院一直致力于研究诱导多能干细胞技术的相关机制。
2010年,广州生物院的裴端卿研究员及其团队发现,成纤维细胞由间充质细胞状态转变到上皮细胞状态是重编程早期必需的细胞生物学过程。在此基础上,裴端卿和郑辉的团队做了进一步的深入研究,发现在间充质状态与上皮状态之间的多次转换有利于提高重编程效率。研究成果Sequential introduction of reprogramming factors reveals a time-sensitive requirement of individual factor and a sequential EMT-MET mechanism for optimal reprogramming已于当地时间5月26日在线发表于Nature Cell Biology(《自然·细胞生物学》。
间充质细胞状态和上皮细胞状态是体内两大细胞状态。而由受精卵发育为成熟个体的这一过程不仅是胚胎干细胞分化成为多种体细胞的过程,也是细胞在间充质细胞状态和上皮细胞状态之间多次相互转换的过程。受中国传统阴阳太极理念的启发,广州生物院的科学家们认为:在体细胞向诱导多能干细胞转变的过程中也就是重编程过程中可能也存在着间充质细胞状态和上皮细胞状态之间的多次相互转换。广州生物院的科学家们通过控制可以将成纤维细胞重编程为诱导多能干细胞的四个因子(Oct4, Klf4, c-Myc 和Sox2)在成纤维细胞中的表达时间,发现在重编程细胞中先表达Oct4 和Klf4,再表达c-Myc, 最后表达Sox2可以大幅度提高重编程效率。
通过将这一方法与四个因子同时在成纤维细胞表达方法比较,科学家们发现:1.如果四个因子同时在成纤维细胞中表达,成纤维细胞会由间充质细胞状态转变到上皮细胞状态,再转变为诱导多能干细胞; 2.如果四个因子按照上述顺序在成纤维细胞中表达,成纤维细胞会首先进一步向间充质细胞状态转变,然后再转变到上皮细胞状态以及诱导多能干细胞。
这项研究结果表明,作为体内最重要两大细胞状态,间充质细胞状态和上皮细胞状态对胚胎干细胞分化为体细胞或者体细胞重编程为诱导多能干细胞具有重要意义,而在这两个状态之间的相互转变则是细胞命运转换的重要过程。
该项研究得到中国科学院战略性先导科技专项以及国家自然科学基金的支持。
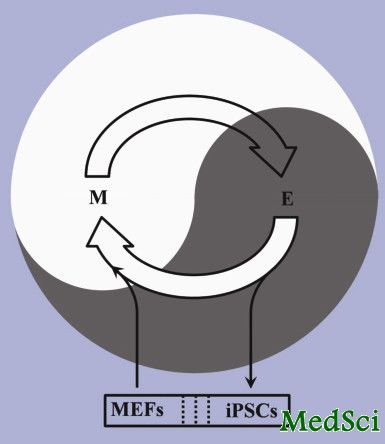
间充质细胞状态(M)和上皮细胞状态(E)之间的阴阳太极。成纤维细胞(MEFs)进入间充质细胞状态和上皮细胞状态之间的阴阳循环之后,首先向间充质细胞状态进一步接近,然后再转变为上皮细胞状态以及诱导多能干细胞(iPSCs)。

Sequential introduction of reprogramming factors reveals a time-sensitive requirement for individual factors and a sequential EMT–MET mechanism for optimal reprogramming
Abstract
Present practices for reprogramming somatic cells to induced pluripotent stem cells involve simultaneous introduction of reprogramming factors. Here we report that a sequential introduction protocol (Oct4–Klf4 first, then c-Myc and finally Sox2) outperforms the simultaneous one. Surprisingly, the sequential protocol activates an early epithelial-to-mesenchymal transition (EMT) as indicated by the upregulation of Slug and N-cadherin followed by a delayed mesenchymal-to-epithelial transition (MET). An early EMT induced by 1.5-day TGF-β treatment enhances reprogramming with the simultaneous protocol, whereas 12-day treatment blocks reprogramming. Consistent results were obtained when the TGF-β antagonist Repsox was applied in the sequential protocol. These results reveal a time-sensitive role of individual factors for optimal reprogramming and a sequential EMT–MET mechanism at the start of reprogramming. Our studies provide a rationale for further optimizing reprogramming, and introduce the concept of a sequential EMT–MET mechanism for cell fate decision that should be investigated further in other systems, both in vitro and in vivo.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Cell#
103
#Bio#
86
#Nat#
60
#CEL#
119
#返老还童#
67