Cell:通过iPS构建大脑类器官,发现额颞叶痴呆的早期迹象
2023-02-26 brainnew神内神外 brainnew神内神外 发表于安徽省
额颞叶痴呆(FTD)是一组致命的、使人衰弱的大脑疾病,占所有痴呆症的5%-6%。值得注意的是,FTD是可遗传的,约50%的病例有家族史,且不少为非老年患者,约占65岁以下病例的20%。
额颞叶痴呆(FTD)是一组致命的、使人衰弱的大脑疾病,占所有痴呆症的5%-6%。值得注意的是,FTD是可遗传的,约50%的病例有家族史,且不少为非老年患者,约占65岁以下病例的20%。
更重要的是,目前还没有有效治愈FTD的方法,早发现、早干预是治疗或延缓这类疾病的最好方法。由此看来,要想让治疗干预发挥最大作用,识别FTD相关的神经细胞死亡之前的分子变化和疾病生物标志物是非常必要的。
2021年7月26日,美国西奈山伊坎医学院的研究人员在 Cell 期刊发表题为:ELAVL4, splicing, and glutamatergic dysfunction precede neuron loss in MAPT mutation cerebral organoids 的研究论文。
该研究构建了可以在培养皿中培养的大脑类器官,重现了被广泛研究的额颞叶痴呆的大部分损伤,以此揭示了突变的tau蛋白是如何触发一类在额颞叶痴呆中脆弱的神经元死亡的。此外,研究人员还表示,一种最初设计用于治疗克罗恩病的实验性药物apilimod可以阻止这些神经元的死亡,从而预示了一种治疗额颞叶痴呆的新方法。
 额颞叶痴呆对于患者和他们的亲人来说是一种毁灭性的疾病,这种病症会影响大脑的前部和侧(颞)区域,导致行为改变,说话和思考困难。然而,了解痴呆症的发病原因是很困难的,因为大多数大脑损伤在症状出现之前就已经发生了。
额颞叶痴呆对于患者和他们的亲人来说是一种毁灭性的疾病,这种病症会影响大脑的前部和侧(颞)区域,导致行为改变,说话和思考困难。然而,了解痴呆症的发病原因是很困难的,因为大多数大脑损伤在症状出现之前就已经发生了。
因此,科学家们想要找到额颞叶痴呆的发病原因,就像侦探试图解开凶手在犯罪现场的犯罪过程一样。这项研究通过对tau蛋白V337M突变患者的大脑病理进行建模,还原了额颞叶痴呆的“犯罪过程”。
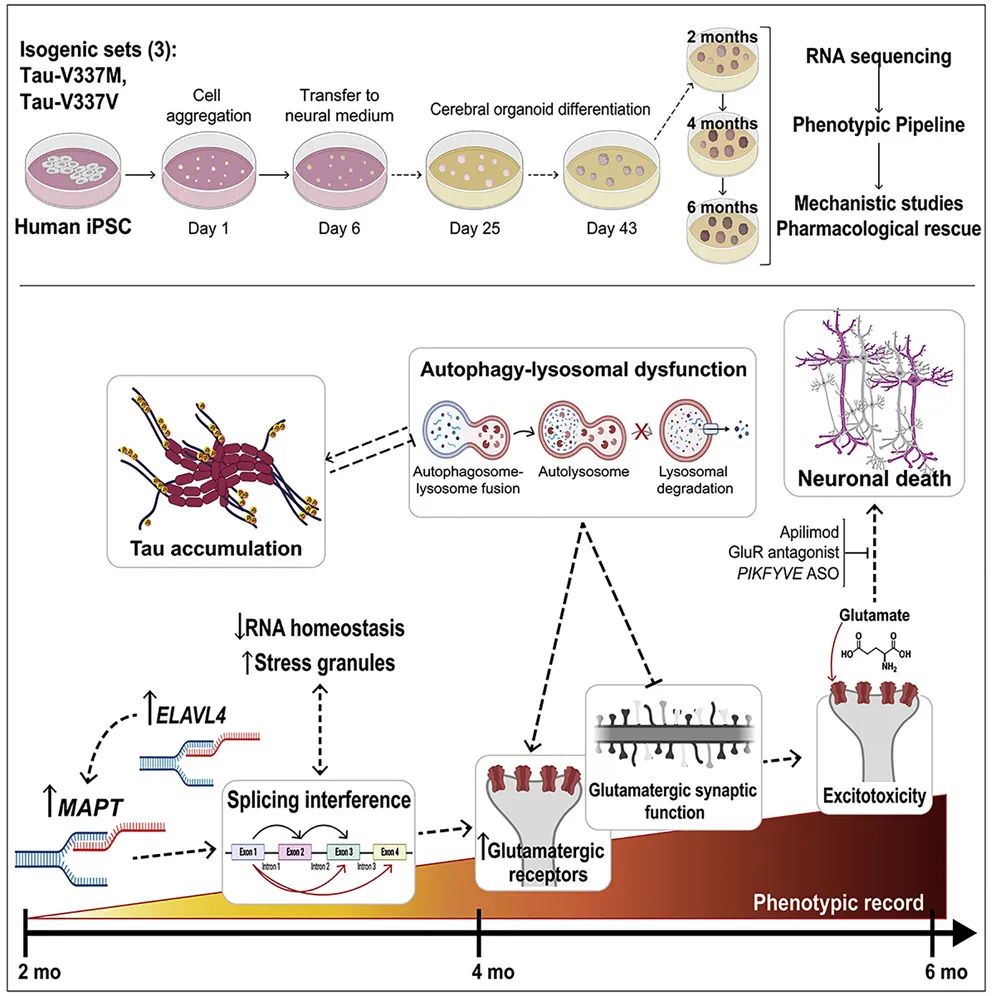 本研究的模式图
本研究的模式图
在这项研究中,西奈山伊坎医学院、纽约伦斯勒神经干细胞研究所、圣路易斯华盛顿大学、麻省总医院和南加州大学的科学家们通力合作,从诱导多能干细胞(iPSCs)中创造了数千个大脑类器官,其中包括iPSC衍生的表达tau-V337M的大脑类器官。
诱导多能干细胞(iPSCs),是通过基因和化学方法将人的成熟细胞重新编程为新生干细胞,这些新生干细胞有潜力成为身体中的任何细胞,甚至形成人体组织的微型和简化版本——类器官,以便与科学家们进行深入研究。
本研究的通讯作者 Sally Temple 博士说道:“诱导多能干细胞是一种强大的研究工具,它允许研究人员在培养皿中个性化研究每位患者的疾病。我们将iPSC-类器官技术与高通量、单细胞基因活性分析相结合,从而更好地了解在疾病发展的早期阶段,甚至在症状出现之前,患者的大脑中可能发生了什么。”
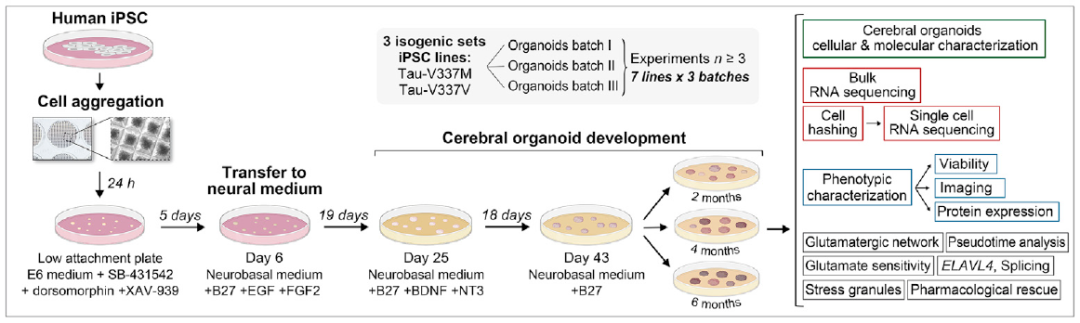
通过诱导多能干细胞(iPSC)构建大脑类器官
研究人员检查了来自3名患者的iPSC-类器官的生长和发育,这些大脑类器官都在tau蛋白中携带V337M突变。然后,研究人员将其与在对照组类器官中观察到的结果进行了比较——对照组同样来自于患者的干细胞,但其中的致病突变经过了基因纠正。
在培养6个月后,研究人员在tau-V337M类器官中发现了神经退化的迹象,这一现象也在FTD患者中可见。更值得注意的是,患者来源的类器官比对照组类器官的兴奋性神经元更少,这表明tau突变足以导致这一特定类别的神经元细胞死亡水平更高。
事实上,兴奋性神经元通常会对神经化学物质谷氨酸产生反应,并在额颞叶痴呆中因异常高水平死亡。此外,病人来源的类器官也有较高水平的tau蛋白的有害变体和较高水平的炎症。
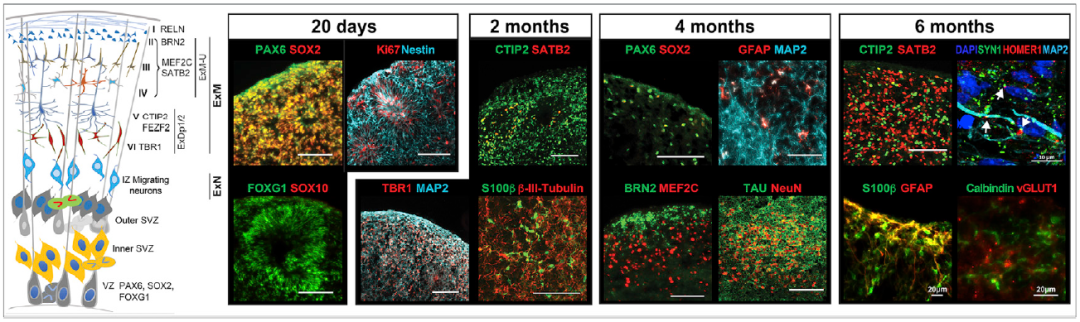
在培养6个月后,tau-V337M类器官出现了神经退化的迹象
文章的第一作者 Kathryn Bowles 博士说:“兴奋性神经元细胞死亡、tau蛋白沉积和炎症是各种形式的额颞叶痴呆损伤的典型特征。因此,我们接下来想知道的是,在这些疾病特征出现之前发生的细胞和分子过程是什么。”
基于此,研究人员回溯调查了培养两个月和培养四个月的患者来源类器官。他们发现,在2个月时,突变的类器官显示微管相关蛋白(MAPT)、谷氨酸信号通路和调节器的表达上调,以及应激颗粒增加。在4个月时,突变体的类器官积累了剪接变化、自噬功能的破坏以及tau和P-tau-S396的形成。

tau-V337M类器官表现为神经元丢失、自噬功能破坏和tau积累
不仅如此,该研究还发现,在最初的几个月里,突变体类器官中的兴奋性神经元比对照组成熟得更快。此外,其他实验表明,这些变化可能是突变的tau蛋白、兴奋性神经元基因和RNA结合蛋白ELAVL4之间复杂相互作用的副产物。
因此,这些研究结果表明,V337M突变型tau蛋白在大脑中引发了一个恶性循环,使兴奋性神经元处于巨大的压力之下而加速死亡。此外,它还加快了成熟所需要的新蛋白质的生产,但阻碍了旧的蛋白的降解过程。
进一步的实验也支持了这一观点:与对照组相比,突变类器官中的兴奋性神经元在谷氨酸中毒水平条件下存活的可能性更小。
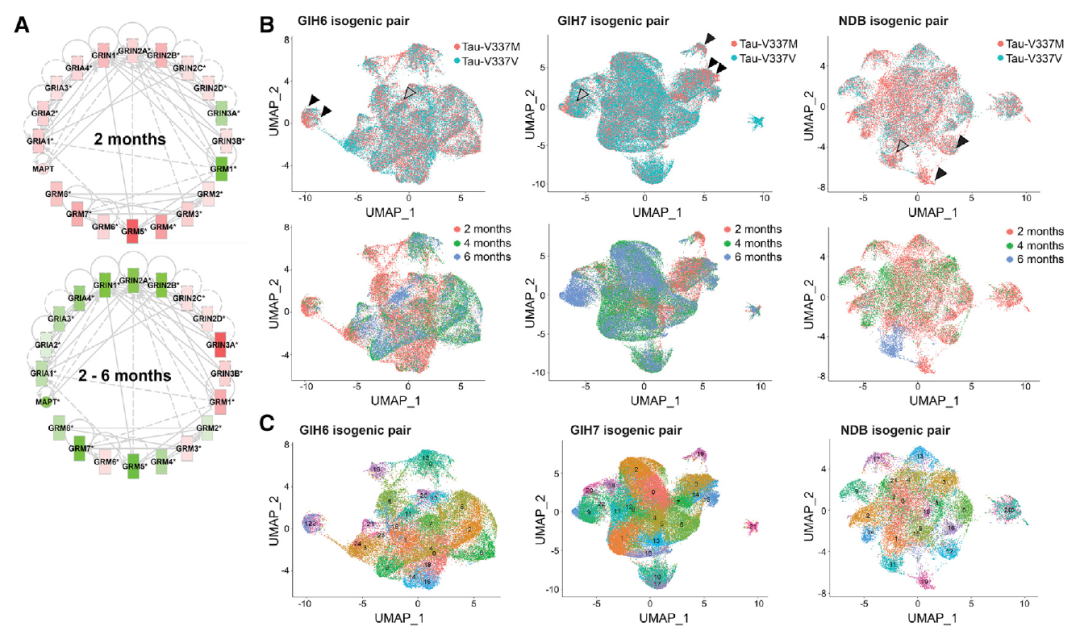
Tau-V337M类器官表现出早期神经元成熟和突触信号通路上调
更重要的是,研究人员还发现,一种最初设计用于治疗克罗恩病的实验性药物——apilimod,可以防止这种情况发生。换而言之,当研究人员用apilimod处理样本时,突变体和对照组的类器官在谷氨酸诱导的细胞死亡水平上没有差异。
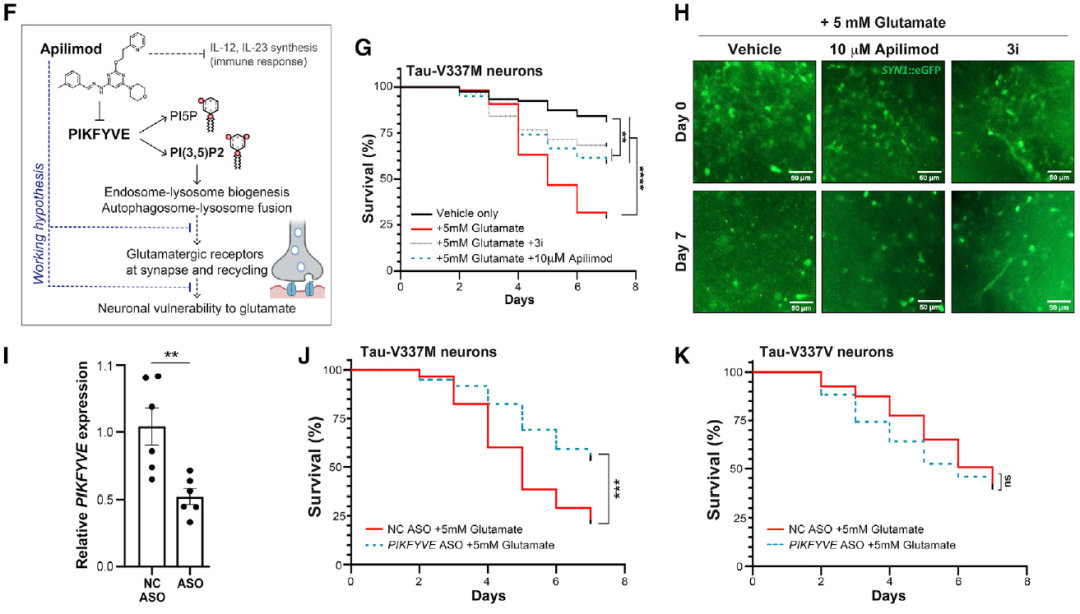
实验性药物apilimod可以用于治疗额颞叶痴呆
对此,本研究的通讯作者 Alison Goate 主任表示:“在大脑类器官等工具的帮助下,我们可以建模并了解痴呆症的成因,并由此确定了几个非常早期的转录组和蛋白质组变化,这些变化导致tau病理和神经元死亡的形成。我们的目标是帮助研究人员开发新的治疗额颞叶痴呆的方法,防止患者及其家人遭受痛苦!”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









老年性痴呆,未来还是希望借助神经电生理吧,也许更为有效!
79