【衡道丨专栏】淋巴瘤病例实战分析:外周T细胞淋巴瘤,非特指型(PTCL-NOS)
2023-08-07 衡道病理 衡道病理 发表于上海
淋巴瘤是中国最常见的恶性肿瘤之一,其病理分类十分复杂,需要形态学、免疫组织化学、流式细胞术、分子遗传学等多种检查同时进行,还要结合患者的临床表现,例如症状、影像检查等综合判断。
01 病史介绍
性别:男性
年龄:65岁
取材部位:右侧颈部肿块
病史:3个月前无意中发现扁桃体肿大及双侧颈部肿块。专科检查:右颌下可触及3.5cm×2.0cm肿块,左侧颈部触及一肿块,大小约2.0cm×1.0cm,肿块质中,活动度可,无压痛。
影像检查:MRI显示左侧扁桃体明显肿大约2.5cm×3.4cm,双侧颈周、颌下区及左侧锁骨区可见多发大小不等结节状影,大小约0.9cm×1.5cm。
临床诊断:扁桃体肿物,颈部多发淋巴结肿大。
大体所见:灰白结节2.3cm×1.6×1.2cm。实性,质中,边界不清。
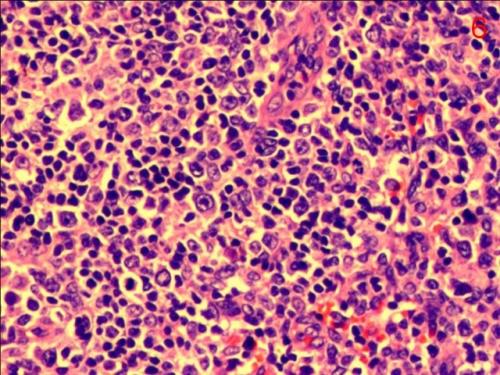
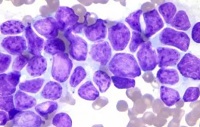
02 镜下所见
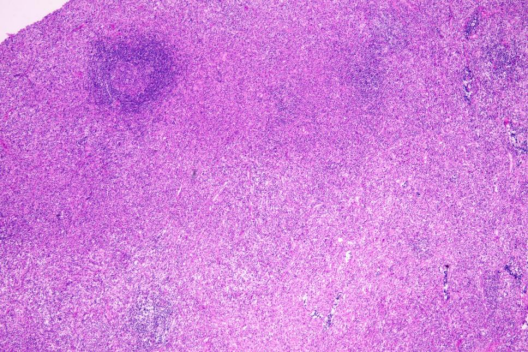
图1
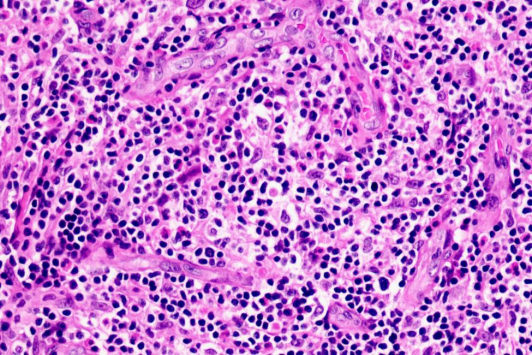
图2
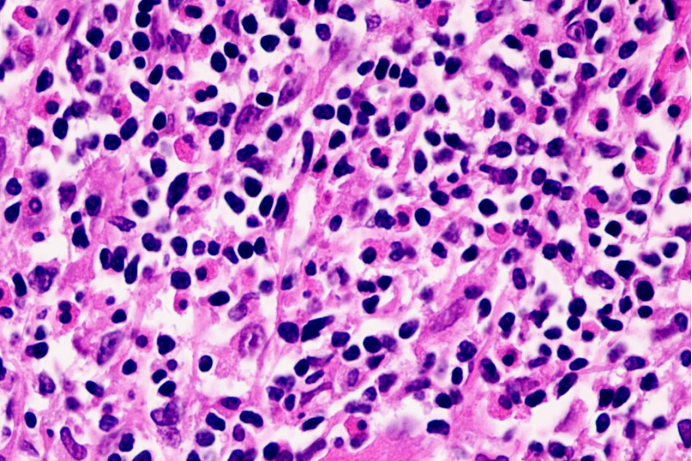
图3
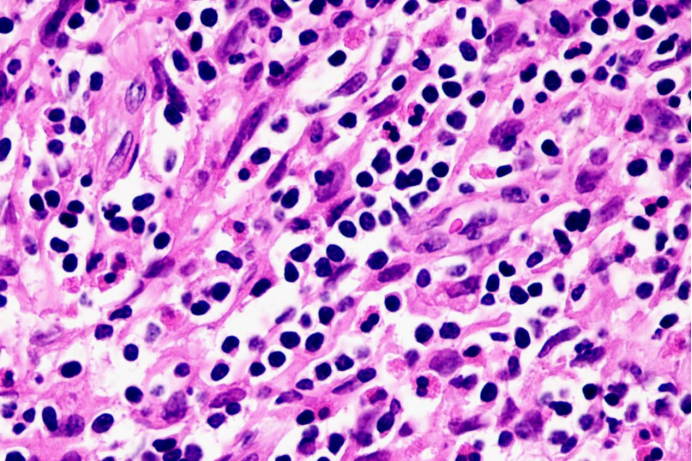
图4
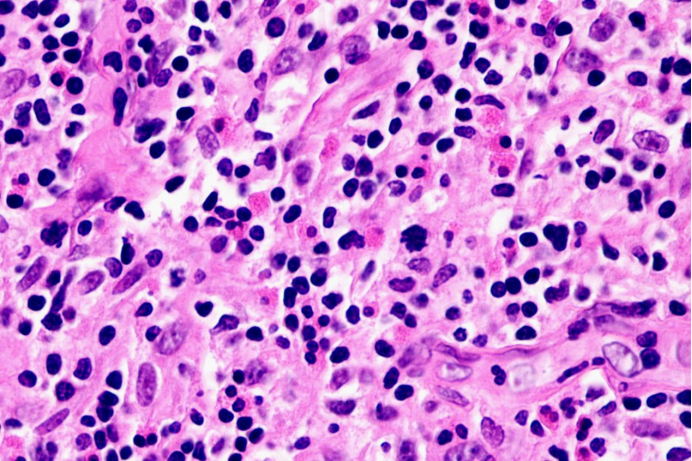
图5
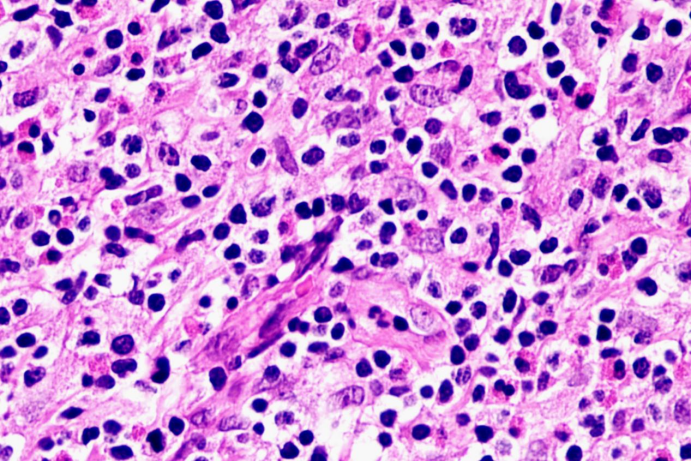
图6
03 免疫组化
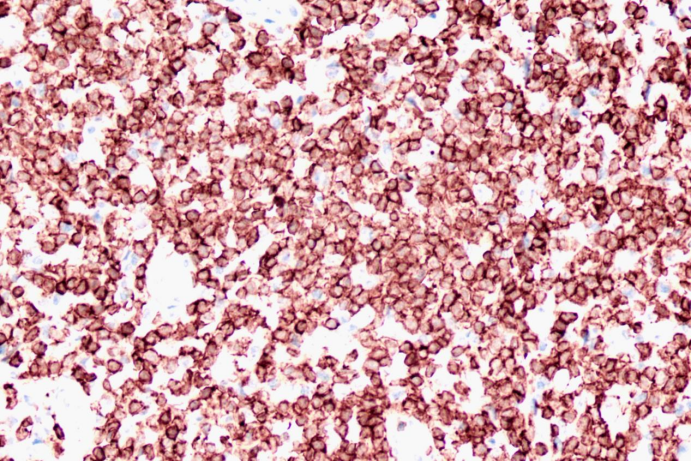
CD3
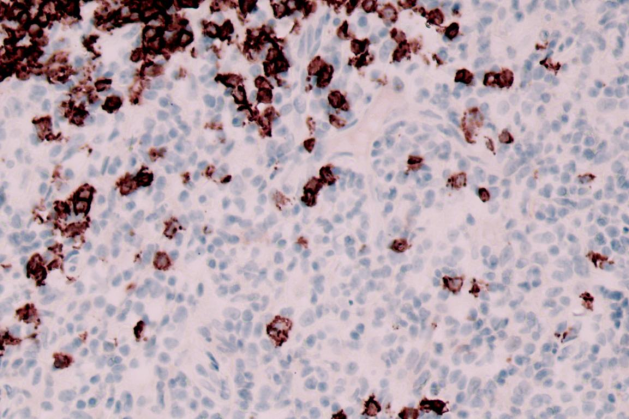
CD20
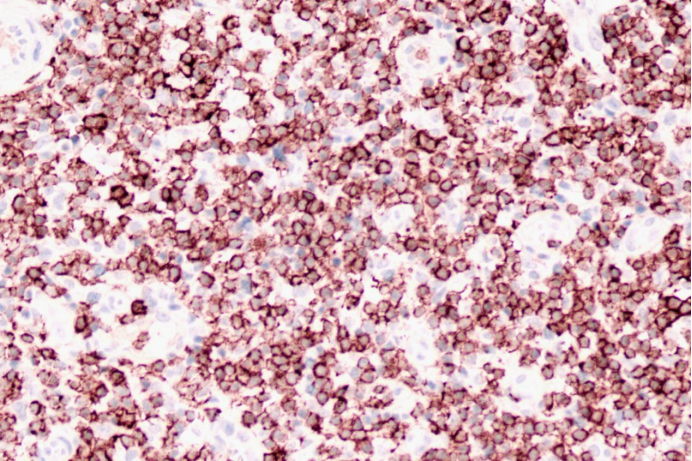
CD2
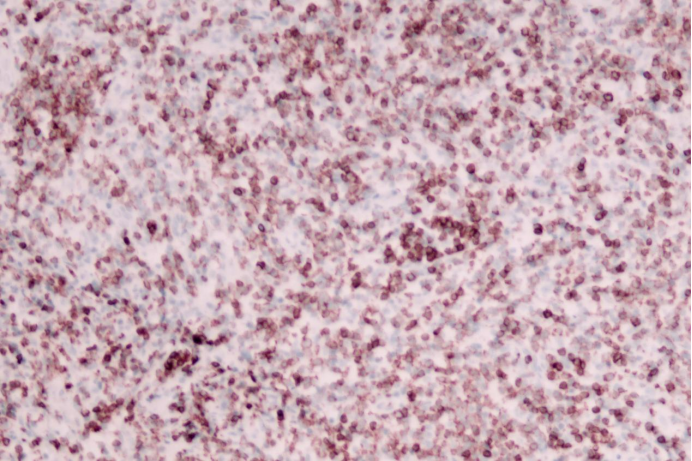
CD7
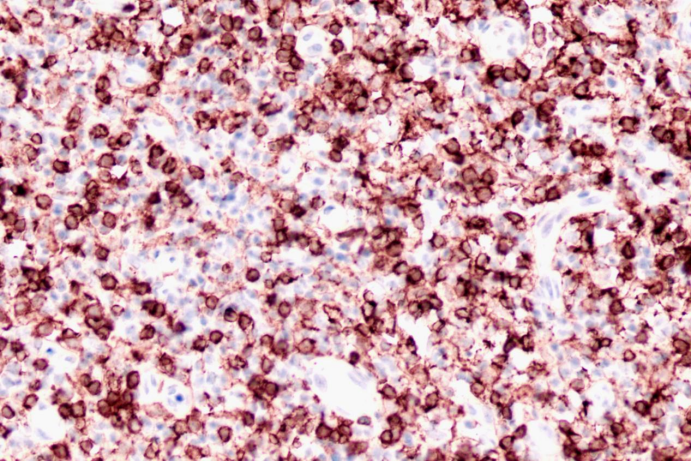
CD4
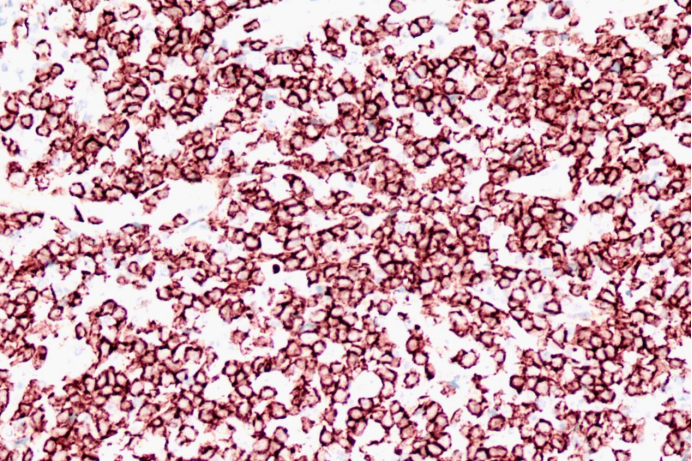
CD8

Bcl-2

Ki-67
免疫组化染色结果:
肿瘤细胞CD3(+)、CD5(+)、CD4(+)、CD8(+)、CD2(大部分+)、CD7(部分+)、Bcl-2(部分+)、Ki-67(50%+)、TIA-1(部分+)、GranzymeB(极少散在+)。
不表达CD56、CD10、Bcl-6、PD1,CXCL-13、CD30、Perforin、CD20、PAX-5、CD79a、AE1/AE3。
淋巴滤泡内树突网CD21、CD23(+)。
04 分子检测结果
T细胞克隆分析:
TCRB A基因重排呈单克隆性重排。
TCRB B 、TCRB C 、TCRG A 和TCRG B基因重排均呈多克隆性重排。
EBV原位杂位检测结果:EBER(阴性)。
05 诊断
“右侧颈部”外周T细胞淋巴瘤,非特殊型(PTCL-NOS)
06 讨论
外周T细胞淋巴瘤,非特指型(PTCL-NOS)是一个异质性的淋巴瘤和排除性诊断,形态学谱系非常广。侵犯淋巴结的模式可为滤泡间、副皮质区或弥漫性浸润。淋巴结滤泡间区浸润而不累及滤泡。弥漫性浸润模式的许多病例表现为中至大的异型细胞,细胞核不规则,部分病例细胞胞质透亮。常混杂有反应性的细胞,如小淋巴细胞、组织细胞、B淋巴细胞、浆细胞和嗜酸性粒细胞。当炎症细胞非常显著时,难于发现异型肿瘤细胞。CD3免疫组化染色有助于显示T细胞及其异型性。嗜酸性粒细胞可为考虑T细胞淋巴瘤提供诊断线索。
PTCL-NOS可见坏死,坏死通常为灶性,而非大片或地图状。
在一些PTCL病例中可见霍奇金样细胞,这些散在的霍奇金样细胞与经典型霍奇金淋巴瘤细胞具有相同的免疫表型。这些霍奇金样细胞可呈EBER阳性。当浸润的浆细胞显著时,需行免疫组化Kappa 及Lambda检测确定细胞的克隆性,PTCL可伴随单克隆EBV阳性的浆细胞或B细胞。对于伴显著浆细胞或非典型B细胞的病例,均应行T细胞受体基因重排分子检测以确定细胞的克隆性。
PTCL-NOS的诊断依据是淋巴瘤的典型组织病理学特征,异常的T细胞免疫表型(通常会丢失CD5和CD7)以及T细胞受体(TCR)基因重排呈现单克隆性。肿瘤细胞阳性表达T细胞抗原(CD2、CD3、CD5、CD7),但其中一个或多个抗原表达减弱或表达缺失者比例较高(78.6%),这也是诊断PTCL重要依据之一。此外,PTCL-NOS的免疫表型以CD4+/CD8-模式为主。可不同程度弱表达CD30。
PTCL-NOS有两种可能的生物学变异型:PTCL-TBX21和PTCL-GATA3,其特征分别为Th-1和Th-2细胞的转录程序。TBX21组(高表达转录因子TBX21、EOMES及其下游靶基因)和GATA3组(高表达转录因子GATA3及其靶基因)。PTCL-TBX21具有异质性,通常预后较好,但其中可能包括一个具有细胞毒性基因表达程序和攻击行为的亚组,具有细胞毒表型且常表达CD8,预后相对较差。PTCL-GATA3组具有统一的分子遗传谱,其基因组学变异复杂,表现为CDKN2A/B-TP53和PTEN-PI3K通路中肿瘤抑制基因的高频缺失或突变,对肿瘤间质的依赖性较小(低表达微环境相关的信号因子),且MYC基因及肿瘤增殖相关基因的表达率较高,这部分患者往往预后较差。
外周T细胞淋巴瘤淋巴上皮样变异型(Lennert淋巴瘤)为PTCL的一种亚型,其有大量的组织细胞掩盖了小的、仅有轻度异型性的肿瘤细胞。背景包括霍奇金样细胞、浆细胞和嗜酸性粒细胞等炎症细胞。该变异型通常局限于淋巴结,结外侵犯不常见。CD3染色有助于显示肿瘤性T细胞,此外,一般而言,T细胞淋巴瘤Bcl-2表达缺失有助于确定其为肿瘤性病变。T细胞基因重排检测是证明细胞克隆性所必需的检查。
一组以侵犯骨骼肌为特征的PTCL-NOS,并具有细胞毒性分子表型,也有称为骨骼肌细胞毒性T细胞淋巴瘤(cytotoxic T-cell lymphoma,CTL),也报道为“肌炎样”T细胞淋巴瘤。细胞毒性分子标记(TIA-1和颗粒酶B)的表达是CTL的主要免疫表型特征,加上CD8+>CD4+的表达模式。肿瘤细胞CD56阴性和EBEB阴性排除了结外NK/T细胞淋巴瘤的可能。当骨骼肌CTL累及骨骼肌以外的组织时应注意结合临床及影像学特征与其他CTL相鉴别,如原发性皮肤侵袭性亲表皮CD8+CTL、皮下脂膜炎样T细胞淋巴瘤等。CD10、PD-1、ALK和CD30阴性有助于PTCL组织学类型的鉴别。
PTCL-NOS发病率至少占PTCL的25%。70%的患者就诊时临床分期为Ⅲ~Ⅳ期,表现为高度侵袭性,预后较差,5年总生存率为20%~30%。“标准疗法”CHOP(环磷酰胺、阿霉素、长春新碱、泼尼松)方案对大多数PTCL患者的疗效并不理想,5年无进展生存率(PFS)为13%~36%,而现有新型靶向药物缺少有效预测疗效的生物标志物。因此,寻找新的标志物和预后预测因子对PTCL患者的诊断和治疗具有重要意义。
07 鉴别诊断
主要包括结节滤泡辅助性T细胞淋巴瘤(nTFHL)和淋巴结EBV阳性T/NK细胞淋巴瘤。
结节滤泡辅助性T细胞淋巴瘤(nTFHL)
以前被称为“血管免疫母细胞T细胞淋巴瘤”、“滤泡性T细胞淋巴瘤”和“TFH表型外周T细胞淋巴瘤”的疾病分别被重新命名为nTFHL血管免疫母细胞型(nTFHL-AI)、nTFHL滤泡型(nTFHL-F)和没有其他类型的nTFHL(nTFHL-nos)。均起源于滤泡辅助T(TFH)细胞,且表达至少2种TFH相关的免疫学标志物(CD10、bcl-6、PD-1、CXCL13、ICOS、MAF、SAP及CD200)。
nTFHL滤泡型(nTFHL-F)
以前称滤泡变异型外周T细胞淋巴瘤,镜下主要表现为滤泡性淋巴瘤样或生发中心进行性转化样生长模式,其淋巴结看似结节状结构,类似FL,结节内T细胞稍增多。粗略观察可发现结节内CD20阳性小B细胞共表达CD10和Bcl-2,似乎可以用FL解释。但进一步观察可发现Bcl-2阳性细胞数量超过了CD20阳性的B细胞数量,据此可推断T细胞表达Bcl-2、CD10、CD4和PD-1。该病例强调了需比较每种标志物阳性细胞数量的重要性,根据阳性细胞空间分布和数量来判断哪种特定成分(B细胞或T细胞)对应每种标志物的阳性表达。nTFHL滤泡型缺乏AITL中常见的滤泡树突细胞(FDC)网增生模式及分支状高内皮静脉的增生。
nTFHL血管免疫母细胞型(nTFHL-AI)
其淋巴结结构部分或完全消失。瘤细胞浸润至结外脂肪组织,保留被膜下窦开放(“跳跃性改变”)。显著的分枝高内皮小静脉。非典型小至中等大小淋巴细胞、胞质透亮,核轻度不规则。非典型T淋巴细胞CD3阳性(通常较弱)、CD4阳性。通常表达CD5,但CD7表达缺失。表达PD-1、CD10、Bcl-6、ICOS和(或)CXCL-13。混杂有嗜酸性粒细胞、免疫母细胞和浆细胞。CD21阳性滤泡树突细胞网扩张,并向滤泡外延伸(增生紊乱的滤泡树突网)。散在的EBV阳性细胞(常见,但并非见于所的病例)。nTFHL-AI可伴B细胞性的霍奇金样细胞,这些细胞通常呈EBER阳性。可误诊为CHL。这些细胞Pax-5、CD30和CD15为阳性,可表达CD20。背景T细胞可仅有轻度的非典型性或被忽视。在许多情况下,霍奇金样细胞成灶聚集,类似ALCL。采用免疫组化染色PD1、ICOS、CXCL-13、CD10和Bcl-6确定TFH细胞的密度,以及T细胞受体基因重排确定细胞的克隆性是有帮助的。这个特殊的病例,流式细胞术还检测到CD3阴性、CD4和CD10阳性的异常T细胞群。
nTFHL-NOS
是具有TFH表型的CD4+淋巴瘤且不符合nTFHL-AI或nTFHL-F的标准,缺乏多形性炎性细胞背景,肿瘤细胞单一,亦无分支状高内皮静脉的增生及FDC网增生。在作穿刺活检报告时,建议使用通用术语nTFHL而不是nTFHL-nos,以防止由于取样不足而导致的错误分类。TFH表型被认为除了CD4外,还存在至少两个TFH标记。
淋巴结T滤泡辅助细胞淋巴瘤,血管免疫母细胞型(nTFHL-AI)是具有明确临床、形态学、免疫表型和特征性突变的原型。从遗传学上讲,nTFHL-AI的特点是在造血干细胞早期发生TET2和DNMT3A突变,逐步获得体细胞变化,而RHOA和IDH2突变也存在于肿瘤性TFH细胞群中。相反,nTFHL-F和nTFHL-NOS代表研究较少的淋巴结淋巴瘤,它们也表达TFH标记物,如PD1、ICOS、CXCL13、CD10和BCL6,并显示与nTFHL-AI相似的突变谱。
淋巴结EBV阳性T/NK细胞淋巴瘤
约占外周T细胞淋巴瘤,非特殊型的10%(2016版WHO)。此型常见于老年人或有免疫缺陷基础病的患者,通常表现为淋巴结病,伴有或不伴有结外受累、晚期疾病和B症状;预后很差。形态学上,该淋巴瘤通常类似于弥漫大B细胞淋巴瘤,肿瘤细胞形态较单一,通常表现为中心母细胞样伴RS样细胞或多核巨细胞,无明显血管中心性生长及凝固性坏死特点,或坏死少见,与NK/TCL不同。大多数呈EBV阳性,具有细胞毒性表型,表达CD8。该肿瘤细胞通常为T细胞来源,小部分病例为NK细胞来源。这些病例免疫表型上呈CD4与CD56阴性。与NK细胞免疫表型相比,它更常显示细胞毒性T细胞;根据定义,EBV为阳性。遗传学改变不同于ENKTL,最常见的突变基因是TET2。
参考文献:
[1]王雅婧,张红玲,李静等.GATA3和bcl-11b在外周T细胞淋巴瘤中的表达及临床意义[J].中华病理学杂志,2021,50(8):904-909.DOI:10.3760/cma.j.cn112151-20201224-00955.
[2]李文才.关注淋巴瘤的临床及分子病理进展[J].中华病理学杂志,2021,50(6):557-559.DOI:10.3760/cma.j.cn112151-20210406-00261.
[3] 王冠男,赵武干,张丹丹,张延平,黄雪洁,李文才.原发EB病毒阳性结内T/NK细胞淋巴瘤的临床病理学分析[J].中华病理学杂志,2020,49(10):1009-1014.
[4] Amy S.Duffied,Joo Y.Song,Girish Venkataraman.淋巴结病理学图谱:基于模式的诊断方法 中国科学技术出版社,2022.8第1版
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言