呼吸机用了这么久,你关注过人机不同步吗?|精选
2016-12-17 李宏亮 医学界急诊与重症频道
呼吸机出现至今已有七十余年的历史,早已成为临床上各种原因所致呼吸衰竭,以及其它各类需要呼吸功能支持疾病的最主要的治疗方法。然而在其大规模普及应用的今天,仍然有很多的临床医生还仅仅将关注点放在其缓解呼吸肌肉疲劳,改善通气及氧合等基本的功能上。虽然生命体征得以维持,血气指标得以改善,但是患者的主观感受以及肺组织的通气是否安全合理却常常被忽略。要知道,即使是超过二十年应用历史的辅助通气模式,还是会有
呼吸机出现至今已有七十余年的历史,早已成为临床上各种原因所致呼吸衰竭,以及其它各类需要呼吸功能支持疾病的最主要的治疗方法。然而在其大规模普及应用的今天,仍然有很多的临床医生还仅仅将关注点放在其缓解呼吸肌肉疲劳,改善通气及氧合等基本的功能上。虽然生命体征得以维持,血气指标得以改善,但是患者的主观感受以及肺组织的通气是否安全合理却常常被忽略。要知道,即使是超过二十年应用历史的辅助通气模式,还是会有四分之一的有创机械通气患者[1]会出现严重的不同步现象,无创通气更是高达40%[2]。最新文献显示不同步指数(单位时间内不同步呼吸次数/(总触发及未触发的呼吸次数)*100%)超过10%会显著延长机械通气时间、住ICU时间及总住院时间,增加病死率[3]。更多对患者的负面影响现在并未得到很好的研究证实。
目前的现状是,临床医生根据自身的呼吸病理生理学基础+临床经验去选择呼吸机模式并调整各项参数,以期去满足患者的个体需求。要知道,在“医生大脑”与“患者肺组织”之间,有太长的信号传导链条,加上复杂的反馈机制及多种无法消弭的影响因素,必然决定了医生所给予的,可能与患者需要的,相差十万八千里。各种令人眼花缭乱的机械通气模式在特定的情况下(例如深度镇静、肌松、神经肌肉系统疾患),可以基于既往的研究数据资料,临床医生的对呼吸生理的掌握水平,以及呼吸机内置的复杂运算推导,实施非常“精准”的治疗:无论是潮气量,气流速度、气道压力,吸气/呼气时间等等均在医生的掌控之中。但一旦患者的自主呼吸功能恢复,但尚且无法脱离呼吸机的帮助,那么这种“精准掌控”反而会成为干扰患者呼吸节奏,增加人机对抗甚至给患者带来心理恐惧的不利因素。通过呼吸机控制的参数和变量越多,越容易出现人机不协调。这个道理同计划经济及市场经济的异同点是类似的。我们很难评价到底是计划更合理还是市场更科学,一切优略性都取决于其实施背景。
机械通气的两大类型中,控制通气完全不考虑患者在气体输送过程中扮演的作用。患者的神经/肌肉驱动在药物的作用下部分或完全失效,每一次呼吸都是被按照预定设计严格执行的。这一过程实施起来非常简单,但也容易为临床医生在无法有效解决人机对抗的情况下滥用。辅助通气设计初衷,其一是要通过保留患者的自主呼吸,逐步锻炼患者的呼吸肌肉力量,避免呼吸机诱导的膈肌功能障碍;另外一个重要目的就是减少人机对抗,改善患者的不舒适感并促进脱机。人机之间的密切关联使得这一过程非常复杂,无论哪一种模式,呼吸机的送气方式都必须与患者的呼吸模式完美匹配,否则必定会发生人机不协调。
我们以临床常用的几种呼吸模式为例,来简要分析一下人机不同步的几种类型:
容量辅助/控制(Volume Assist/Control,VA/VC)模式下,潮气量、送气峰流速、流速模式及吸气时间,或者直接设置,或者是通过变量之间相互关联间接设定,唯一的可变量就是气道压力。患者不得不在一个精准设定的吸气时间内,接受在严格限定好的气流速度及流速模式下呼吸机输送的固定潮气量,其呼吸中枢被迫据此来进行自我调节,而这是非常困难的,以至于人机不同步在有自主呼吸保留的情况下无法避免。压力辅助/控制(Pressure Assist/Control,PA/PC)模式要相对好一些,因为呼吸机只控制送气压力及送气时间。此时患者保留有控制气流速度及模式,并进而控制潮气量的能力。压力辅助通气(PSV)是经典呼吸机模式中对患者干预最少的,临床医生只是设定送气压力。但以上模式患者都不得不“屈从”于呼吸机,被迫调整自身的呼吸中枢驱动发放以努力“匹配”临床医生为他们套上的种种“枷锁”,只是程度不同而已。
具体的人机不同步类型可大致分为:流速不同步、触发不同步、切换不同步、模式不同步。
流速不同步时,呼吸机的送气流速与患者需求不匹配。如果患者的吸气流速超过呼吸机的供给时,患者的呼吸做功增加,进而导致呼吸频率增快。多见于定容模式。
触发不同步又可以分为触发延迟(Trigger delay)、无效触发(missed triggering/ineffective triggering)、自动触发(auto-triggring)及双重触发(double-triggering)。
设置不当的触发灵敏度可在任何呼吸模式下产生触发延迟,其中又包括了吸气触发延迟及呼气触发延迟。即使设置得当,由于呼吸机对患者的呼吸做功有一个探测过程,因而目前技术下触发延迟是不可避免的,如下图:

图1:PSV模式,PS 8 cm H2O,Flow Trigger 1L/min,Vt 7.8 ml/kg。这是比较理想的通气状态,由于吸气触发本身的工作原理,呼吸机还是会有48 ms的延迟。
无效触发是指患者的吸气努力未能触发呼吸机送气。其产生原因一是吸气力量太弱不足以触发,另一是内源性PEEP(过大的潮气量,以及呼吸机送气过程延长到神经呼气时间)的存在,增加了能够触发呼吸机的做功负荷。其主要发生于呼气相,偶可见于吸气相。其发生率通常随着压力支持水平的上升而升高,特别是COPD患者,高的压力支持水平导致更大的潮气量,更短的呼气时间,肺的动态充气产生内源性PEEP。此时适当使用外源性PEEP有减少患者触发呼吸做功,从而降低无效触发的发生率。

图2:PSV模式,高支持水平(可见食道压Pes后半程完全由负向变为正向)。由于内源性PEEP的存在,虽然患者有吸气需求,但不足以触发呼吸机,导致未得到任何吸气支持,无效做功(wasted effort)。在没有食道压力或膈肌起搏电位信号检测的情况下,非常难以从呼吸机提供的波形图中予以识别。
自动触发是指在没有患者吸气做功的情况下,呼吸机启动一次送气过程。在任何呼吸模式下均可能发生,可以是触发灵敏度设置不当、管路漏气,也见于高动力性循环下的心源性震荡(例如心脏外科术后)。值得一提的是,在脑死亡患者,心血管的高循环动力状态与肺组织之间的交互作用可以改变气道内压力及流速,模拟出内源性的呼吸驱动,给临床医生造成患者仍然有自主呼吸的假象。其发生率在这一特殊群体中的可高达4.8%,无论给医生和家属都造成困惑,严重干扰脑死亡的及时诊断,浪费医疗资源并延迟了器官移植的及时开展[4] [5]
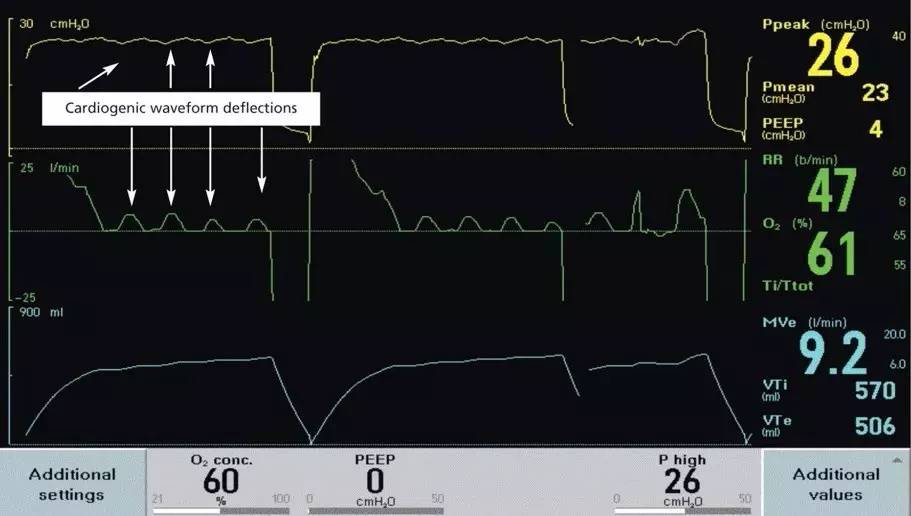
图3:通过与心电图、脉搏搏动等波形震荡频率相对比,在一例脑死亡患者的呼吸机波形图中可以观察到与心动周期一致的气道压力及流速波形折曲。压力波形的位移大约为2-3 cm,流速波形位移约为5.0-6.5 L/min。(摘自Am J Crit Care. 2009 Sep;18(5):496, 488-95.)
当呼吸机输送的潮气量低于患者的需求,或设置的吸气时间短于神经吸气时间(neural inspiratory time),可导致双重触发。多见于定容通气,定压通气压力设置过低也可发生,如下图:

图4:PSV模式,低压力支持水平下,患者的一次吸气努力(一次完整的食道压Pes变化)所需要的潮气量无法为呼吸机的送气压力所满足。在气道压达到预设的PS水平后无法继续升高,吸气流速触峰后开始下降。当其降至预设的呼气触发灵敏度(此处设置为峰值的1%),呼吸机送气阀门关闭,结束一次通气。但此时患者仍保持有持续的吸气努力,使得气道内气流速度变化再次达到吸气触发灵敏度,从而二次触发呼吸机送气。有经验的临床医师通过仔细观察呼吸机的压力波形曲线,能够相对容易将其识别。
周期不同步发生在患者的吸气时间与呼吸机设置的吸气时间不匹配,可以是短周期(吸气时间短于平均吸气时间的一半),也可以是长周期(吸气时间长于平均吸气时间的两倍)。这一类型多见于定压通气,也可在定容通气模式下引起双重触发。长周期往往可以在呼吸机送气阶段的尾部,观察到一个突然出现的压力升高,这一般是由于患者主动呼气而呼气阀门尚未打开所致,有时也见于吸气肌肉的突然松弛[6]。
模式不同步是指模式选择不当,产生大量的人机不同步,可直接反映临床医生对呼吸生理、呼吸机工作原理的掌握程度及临床经验的水平。
迄今为止,成比例辅助通气(Proportional Assist Ventilation,PAV)以及神经调节辅助通气(Neurally Adjusted Ventilatory Assist,NAVA)是减少人机不同步,实施“真正的”肺保护性通气策略最为有效的呼吸模式,原因在于二者并非通过设置压力、流速、容量及时间去“控制”患者的呼吸模式,而是根据患者的吸气努力去按比例提供辅助的支持。这种情况下,每一次的呼吸都是由患者来主导,呼吸机扮演的角色相较以前从“掌控者”变为“辅助者”。
特别是NAVA,通过敏锐捕捉每一次呼吸周期的膈肌电位信号,基本上实时反映了呼吸中枢发放的指令,消除了既往模式中“呼吸中枢发放指令-呼吸肌肉收缩-气道内压力/流量变化达到触发设置-呼吸机送气”这一冗长的传导链条,简化为“呼吸中枢发放指令-EAdi信号触发呼吸机”,极大缩短了触发延迟时间。更为关键的是,在迷走神经反射正常的患者,每一次的吸气过程中,呼吸机送气压力都会因EAdi信号的变化而及时调整,避免了支持不足或过度支持的弊端:如果NAVA水平设置过低,机体通过反馈机制调整EAdi,通过后者的升高确保从呼吸机得到满意的潮气量;如果NAVA水平设置过高,则通过Hering-Breuer reflex机制下调EAdi,使得EAdi×NAVA level保持在一个相对恒定的水平,使送气压力停留在一个安全平台,潮气量稳定,不致发生气压伤。所以说NAVA模式是患者“控制”呼吸机,因为患者的机体自身最知道自己想要的是什么。“患者大脑-呼吸机-患者肺组织”这一工作原理要远比“医生大脑-呼吸机-患者肺组织”要合理得多,从而消除了很多人机不同步的存在。
以前人机不同步的研究之所以不易开展,主要是因为让有经验的临床医生全天24小时守在呼吸机旁观察压力、流速波形是不现实的,即使将数据下载下来靠人工对每一次呼吸逐一识别的工作量也极为巨大,这也是为何前期研究中仅仅纪录并分析几分钟至多几十分钟呼吸机监测数据的原因。直到2013年,NAVA的发明者Sinderby教授提出一种基于EAdi信号波形与呼吸机压力波形对比的自动、客观、标准化的评估工具以及全新的神经同步指数(NeuroSync index),才使得大规模对人机不同步进行定量测定并直观显示成为可能[7]
。相较于传统的不同步指数只能探测不同步(asynchrony),NeuroSync Index更是将人机交互按照神经呼吸时间与呼吸机供气周期的起始点之间的差异,细化为同步(synchrony)、同步不良(dyssynchrony)及不同步(asynchrony)。这样不但可以将传统的无效触发、双重触发、自动触发及吸气提前/延迟、呼气提前/延迟等主要不同步指标纳入且更为敏感,而且实现了定量评估不同步程度这样以前无法完成的分析。临床医生可以据此实时监测人机同步性并相应采取调整措施,提高机械通气的安全性及有效性。这一强大高效的研究工具必将为今后人机不同步研究提供有力的支撑。
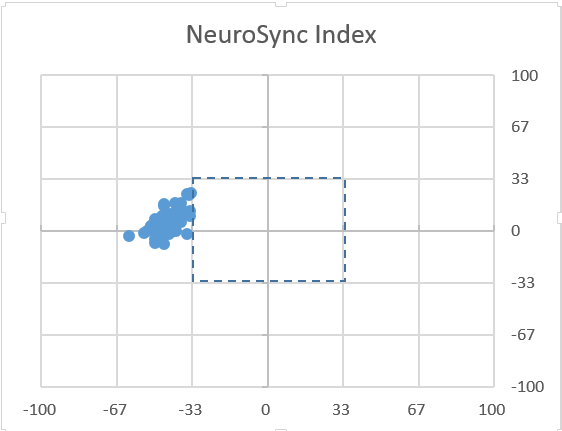

图5: NeuroSync Index示意图。上图为PSV模式,下图为NAVA模式。
图中两种模式的目标潮气量均为7-8 ml/kg。纵坐标为吸气触发,横坐标为呼气切换,均以百分比表示。对特定一次呼吸周期的神经吸气/呼气时间点及呼吸机送气/停止送气时间点之间的差异进行比较,负值表示呼吸机送气/停止送气在神经吸气/呼气开始之前,正值表示在其之后。落在33%区间之内可视作协调(synchrony),33%-100%为同步不良(dys-synchrony),超100%即为不同步(asynchrony)。无效触发,自动触发等都标记为100%的触发/切换错误,因此都属于不同步。从左图看出,PSV模式下的呼吸虽然在吸气触发上都与神经吸气开始时间相差不大(触发足够灵敏),但呼气切换均明显提前,提示虽然患者仍有吸气需求,但可能设置的压力支持水平不够,呼吸机过早切换为呼气,此种情况下往往会导致双重触发的发生。右图为NAVA模式,有一定程度的吸气延迟(一般情况下是心电信号干扰所致),呼气基本都与神经呼气时间紧密贴合(NAVA模式下呼气切换为EAdi峰值的70%),总体上全部落在33%的框架内,可以认为人机同步性满意。
参考文献:
1. Thille AW, Rodriguez P, Cabello B, Lellouche F, Brochard L: Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive care medicine 2006, 32(10):1515-1522.
2. Vignaux L, Vargas F, Roeseler J, Tassaux D, Thille AW, Kossowsky MP, Brochard L, Jolliet P: Patient-ventilator asynchrony during non-invasive ventilation for acute respiratory failure: a multicenter study. Intensive care medicine 2009, 35(5):840-846.
3. Blanch L, Villagra A, Sales B, Montanya J, Lucangelo U, Lujan M, Garcia-Esquirol O, Chacon E, Estruga A, Oliva JC et al: Asynchronies during mechanical ventilation are associated with mortality. Intensive care medicine 2015, 41(4):633-641.
4. Wijdicks EF, Manno EM, Holets SR: Ventilator self-cycling may falsely suggest patient effort during brain death determination. Neurology 2005, 65(5):774.
5. Arbour R: Cardiogenic oscillation and ventilator autotriggering in brain-dead patients: a case series. Am J Crit Care 2009, 18(5):496, 488-495.
6. Georgopoulos D, Prinianakis G, Kondili E: Bedside waveforms interpretation as a tool to identify patient-ventilator asynchronies. Intensive care medicine 2006, 32(1):34-47.
7. Sinderby C, Liu S, Colombo D, Camarotta G, Slutsky AS, Navalesi P, Beck J: An automated and standardized neural index to quantify patient-ventilator interaction. Critical care (London, England) 2013, 17(5):R239.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#呼吸机#
60