阿尔茨海默病药物Donanemab三期临床结果喜人!有望超越Lecanemab
2023-05-03 MedSci原创 MedSci原创 发表于上海
阿尔茨海默病药物Donanemab三期临床结果喜人!有望超越Lecanemab
要点:
- 根据其制造商 Eli Lilly 的临床试验数据,接受 donanemab 治疗的患者的记忆力、思维能力和日常活动能力下降速度降低了 35%。
- 每月抗体输注也显着减少了与阿尔茨海默病相关的脑斑块。
- 虽然结果很有希望,但 donanemab 也存在脑肿胀和出血的风险,在极少数情况下可能会严重甚至致命。
- 礼来计划最快在本季度向食品和药物管理局申请 donanemab 的批准。
三期临床试验结果喜人
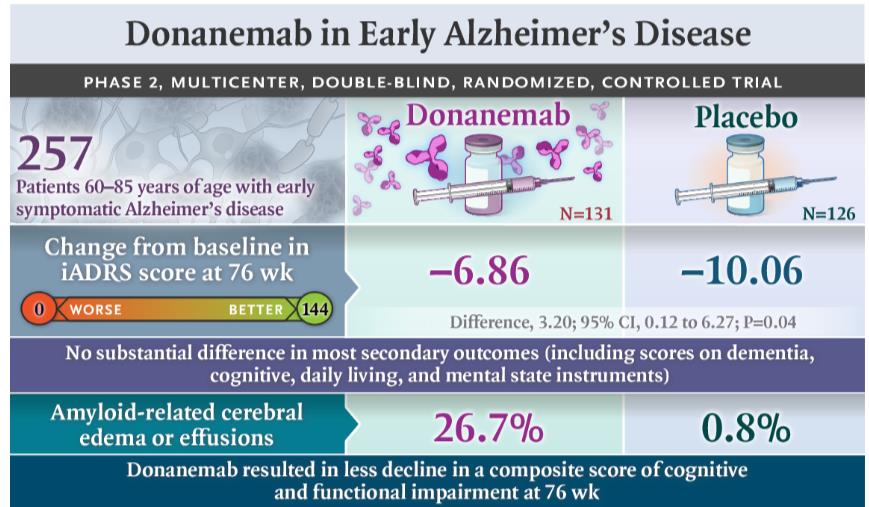
2023年5月3日,礼来公布Aβ抗体Donanemab治疗阿尔茨海默症三期临床TRAILBLAZWE-ALZ2的最新数据,研究达到iADRS主要终点,显著延缓认知功能下降。在为期 18 个月的研究中,Donanemab治疗相比于安慰剂,将认知功能下降(iADRS)延缓了35%(主分析人群)。

对于次要终点CDR-SB,Donanemab延缓下降36%(主分析人群)。如果加上Tau高表达的人群,合并分析iADRS和CDR-SB延缓下降分别为22%和29%。
根据试验结果,使用多那单抗的患者在研究期间进展到疾病下一阶段的可能性降低了 39%。
作用机制独特
Donanemab靶向Aβ的特定形式,即N端第3位焦谷氨酸化的Aβ,简称N3pG-Aβ。这种N3pG-Aβ更容易聚集,因而成为备受关注的AD治疗靶点。
周三,礼来公司的股票在盘前交易中上涨超过 6%。
FDA有望批准上市
据礼来公司称,礼来计划最快在本季度向美国食品和药物管理局申请批准多纳单抗。 该试验研究了阿尔茨海默氏症早期阶段的个体,这些个体已确认存在与该疾病相关的脑斑块。
礼来公司首席科学和医学官 Daniel Skovronsky 博士说,donanemab 在临床试验中证明了所有阿尔茨海默氏症治疗的最高水平疗效。 他说,公司正在努力让 donanemab 尽快获得批准并上市。Skovronsky 相信 FDA 也有同样的紧迫感。
他在接受 CNBC 采访时说:“每一天,都有一些患者度过了阿尔茨海默病的早期阶段,变得更加晚期,他们无法从治疗中获益。” “这是一种非常紧迫的紧迫感。”
礼来(Lilly)此前申请了 donanemab 的加速批准。
FDA 在 1 月份拒绝了该请求,并要求该公司提供更多有关接受该抗体至少 12 个月的患者的数据。 礼来(Lilly)公司表示,当时无法获得数据,因为许多患者能够在六个月时停止给药,因为治疗可以快速清除斑块。
根据周三公布的数据,近一半接受多那单抗治疗的患者(47%)在治疗开始一年后未出现疾病进展,而未接受抗体治疗的患者中这一比例为 29%。
超过一半的患者在第一年完成了治疗,72% 的患者在 18 个月内完成治疗,原因是脑斑块的清除。
在一项单独的测量中,接受多那单抗治疗的患者在 18 个月时的日常活动能力下降幅度减少了 40%。 这意味着与未接受治疗的人相比,他们可以更好地管理财务、开车、追求爱好和进行对话。
“这些是迄今为止阿尔茨海默病治疗的最有力的 3 期数据。 这进一步强调了我们在阿尔茨海默氏症领域所处的拐点,”阿尔茨海默氏症协会首席科学官 Maria Carrillo 在一份声明中说。
donanemab减少脑斑块作用显著
Donanemab 靶向与阿尔茨海默病相关的脑斑块。 据 Lilly 称,这种治疗早在治疗后六个月就显着减少了斑块。 据该公司称,许多患者看到如此显着的减少,以至于他们在 PET 扫描中检测出斑块是否存在。
Donanemab 在 6 个月时清除了 34% 的患者的斑块,这些患者的一种叫做 tau 的蛋白质处于中等水平,这种蛋白质会变得有毒并杀死神经元。 在 12 个月时,多那单抗清除了 71% 具有相同 tau 水平的患者的斑块。
Skovronsky 在接受采访时说:“清除牙菌斑的药物,特别是如果你可以完全清除牙菌斑并快速完成,可以为患者带来非常显着的临床益处,这应该是明确的。”
“在疾病过程中越早这样做,就越能减缓疾病的发展,”他说。
Banner 阿尔茨海默病研究所执行主任 Eric Reiman 博士说,结果并不一定意味着斑块完全消失,但多那单抗清除斑块的程度使得治疗消除了可测量的斑块证据。 Banner 阿尔茨海默病研究所有两名医生作为主要研究者参与了 donanemab 试验。
donanemab导致脑肿胀和出血风险相对轻微
Donanemab 会导致患者脑肿胀和出血,在某些情况下可能会很严重甚至致命。 据礼来公司称,三名试验参与者死于这些副作用。
在卫材和百健(Biogen)的 Leqembi 等其他阿尔茨海默氏症抗体治疗药物中也观察到了这些类型的副作用,后者在 1 月份获得了 FDA 的加速批准。
Reiman 说,他对患者的潜在临床益处感到鼓舞,但重要的是要清楚风险。
Reiman 说:“我们还需要明确副作用的存在,包括一种不常见但可能是灾难性的风险。” 他说:“我们需要继续尽最大努力了解个体患者的风险,告知患者和家庭护理人员,并尽一切努力降低这种风险。”
接受多那单抗治疗的患者中约有 24% 在 MRI 上显示脑肿胀,但只有 6% 显示出实际症状。 大约 31% 的患者出现称为微出血的小脑出血,而未接受治疗的患者中这一比例为 13.6%。大约 1.6% 的肿胀和出血病例很严重。
Skovronsky 说,每位患者都需要与他们的医生进行讨论,权衡 donanemab 的潜在益处和可能的风险。
与Leqembi相比,可能更具竞争力
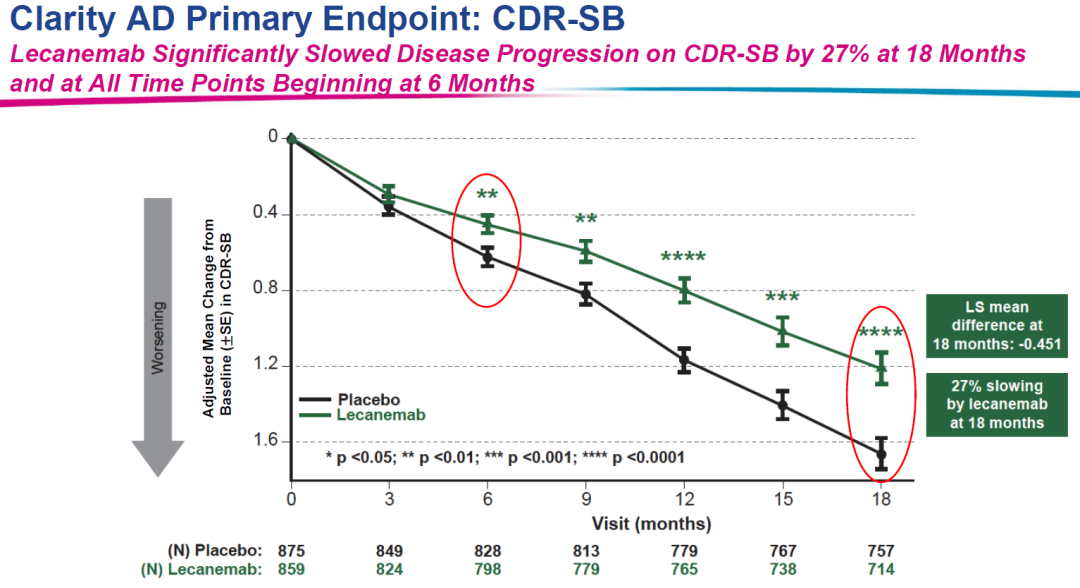
2023年1月6日,美国FDA通过加速审批途径批准渤健(Biogen)和卫材(Eisai)联合开发的Leqembi (lecanemab-irmb),用于治疗阿尔茨海默病(AD)。FDA还表示,计划召开一次咨询委员会会议来讨论该药物,希望听取独立专家咨询委员会的意见。这个委员会的会议日期尚未确定。FDA对Leqembi发布监管决定的目标日期是7月6日。Lecanemab是一种人源化免疫球蛋白γ1(IgG1)单克隆抗体,针对聚集的可溶性和不溶性形式的淀粉样蛋白β。它减少了大脑中的淀粉样蛋白斑块,这是阿尔茨海默病的一个明确的病理生理学特征。Leqembi在1月份获得FDA的加速批准,其依据是2期数据(NCT01767311)显示该抗体药物清除了阿尔茨海默病患者大脑中的β淀粉样斑块。该替代终点表明该药物可能正在发挥作用。
卫材/Biogen的Lecanemab(Leqembi)同样治疗18个月,可以延缓CDR-SB下降幅度27%。因此,礼来Donanemab治疗18个月延缓CDR-SB下降幅度36%的数据可谓非常具有竞争力。而且,Donanemab是三期临床试验数据。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









好
71
老年痴呆有希望了
0
不错,学习了。
70
#阿尔茨海默病#药物#Donanemab#三期临床结果喜人!有望超越#Lecanemab#,两个药物可以打架了!!未来针对Aβ的药物仍然有开发前景!
159