老年痴呆被他玩明白了!剑桥大学破天荒使用人脑样本,首次发现有毒蛋白复制方式!
2021-11-10 李乐一 MedSci原创
美国拉什大学医学中心的研究人员使用降脂药吉非贝齐和维生素A衍生物视黄酸进行联合治疗。他们发现,吉非贝齐和视黄酸联用可能改变星形胶质细胞的作用,让它们成为帮助清除β淀粉样蛋白的工具。
“谁能告诉我,我到底是谁?”安东尼·霍普金斯饰演的主角在电影《困在时间里的父亲》中发出终极之问。

(图片来源:网络)
世界卫生组织发布的最新数据显示,目前全球超过5500万人患有痴呆症,而且患者数量正以每年新发近1000万例的速度不断增长,相当于每3秒就有1人患病。预计到2050年,全球痴呆症患者将达到1.39亿。而这一增长大部分将发生在中国、印度和拉丁美洲等快速发展和人口密集的地区。
这是一种很难研究的疾病,因为它发展了几十年,只有在检查死后的脑组织样本后才能给出明确的诊断。
目前,研究人员主要依靠动物模型来研究这种疾病。然而,动物模型不能很好地再现两种关键蛋白——tau蛋白和淀粉样蛋白的聚集速率,使得研究进展非常缓慢。
人们一直认为,阿尔茨海默病的发展方式与许多癌症类似:导致阿尔茨海默病的有毒蛋白质在一个区域形成聚集体,然后扩散到整个大脑。
然而,近日一项由剑桥大学领导的国际团队打破了这一认知:阿尔茨海默病不是从大脑中的单个点开始并引发导致脑细胞死亡的连锁反应,而是早期就存在于大脑的不同区域,并随着时间的推移不断复制扩增。疾病通过产生有毒蛋白质簇“杀死”这些区域细胞的速度,限定了疾病整体的进展。

(图片来源:Science Advances)
在阿尔茨海默病中,tau蛋白和β-淀粉样蛋白(Aβ)形成缠结和斑块(统称为聚集体),导致脑细胞死亡和大脑萎缩。这会导致记忆丧失、性格改变和日常活动困难。
在本研究中,研究小组“破天荒”地使用了人体样本——阿尔茨海默病患者的死后大脑样本,以及活体患者(从轻度认知障碍患者到综合型阿尔茨海默病患者)的PET扫描,来跟踪tau蛋白的聚集。
研究人员采用了五种不同的tau量化方法,将它们应用于相同的数学模型中,观察到了控制阿尔茨海默病进展速度的机制是大脑各个区域中聚集体的复制,而不是聚集体从一个区域到另一个区域的扩散。

通过对去世的阿尔兹海默症患者的大脑进行解剖学分析,依据Tau蛋白组成的神经纤维缠结的位置将其分成了6个发展阶段,即Braak分期。从1至6期,大脑中神经纤维缠结逐渐增多。
研究团队观察到,Braak 3期后,tau蛋白的分布随时间变化较快。同时,复制的减少显著减缓了tau的总体积累。这意味着Braak 3期之后,tau蛋白累积的整体速率由复制速率决定,抑制复制会最大程度减缓整个过程。
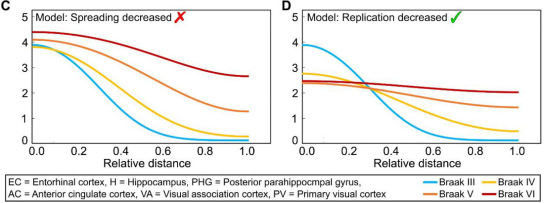
不同Braak期种子浓度变化
( A ) 扩散速率降低
( B ) 复制速率降低
有趣的是,tau蛋白聚集体的复制速度很慢,需要长达5年的时间。
“神经元在阻止有毒蛋白聚合物形成方面令人惊讶地好,但如果我们要开发一种有效的治疗方法,需要找到使它们变得更好的方法。生物学是如何进化到阻止蛋白聚集的,这很吸引人。” 剑桥大学英国痴呆症研究所的David Klenerman教授说,“关键的发现是,在我们研究的疾病阶段,阻止有毒蛋白聚集物的复制而不是它们的传播会更加有效。”
这一研究“刷新”了人们对阿尔兹海默病发展的认知,使阿尔兹海默病治疗迈向了一个新征途。
但迄今为止,仍然缺乏有效的治疗药物。各路人马正前仆后继,不断推出新的治疗方法。
近日在《科学》子刊Science Signaling上发表的研究显示,两款已经上市几十年的“老药”联用,在动物模型中不但显著降低了与阿尔茨海默病相关的β淀粉样蛋白沉积,而且改善了动物的记忆和认知能力。这为治疗阿尔茨海默病提供了另一科学基础。

(图片来源:Science Signaling)
在这项研究中,美国拉什大学医学中心的研究人员使用降脂药吉非贝齐和维生素A衍生物视黄酸进行联合治疗。他们发现,吉非贝齐和视黄酸联用可能改变星形胶质细胞的作用,让它们成为帮助清除β淀粉样蛋白的工具。
同时,在阿尔茨海默病的小鼠模型中,给小鼠服用这两种药物,可以显著降低小鼠大脑中的β淀粉样蛋白沉积,而且小鼠的认知功能在服药两个月后,与对照组相比也获得了改善。
那么这两种药物是如何产生作用的呢?
进一步研究发现,吉非贝齐和视黄酸能够激活细胞中名为PPARα的受体蛋白,该蛋白调控的基因——TFEB的高度表达可以促进β淀粉样蛋白的降解。
此外,这两种药物还刺激低密度脂蛋白受体(LDLR)的表达,LDLR在介导β淀粉样蛋白被细胞摄取方面发挥关键性作用。
这两种作用叠加在一起,增强了星形胶质细胞摄取和降解β淀粉样蛋白的能力。

尽管这一“老药新用”搭配在小鼠模型中成效显著,但能否在人类中起到相同的作用还需要未来更深层次的临床验证。探索已经上市的“老药”新用的一个优势在于这些药物的安全性已经得到了广泛验证,因此可以更快速地展开临床试验,检验它们的疗效。据悉,该项目研究人员已将吉非贝齐和视黄酸组合授权给一家公司,它正在准备递交IND申请,在临床试验中检验这一组合的效力。
目前,阿尔茨海默病等痴呆症仍无法治愈。随着对病因的研究越来越多,期望随着时间的推移,科学家能找到治愈阿尔茨海默病的方法,造福患者。
参考文献:
Aβ Clearance The Uptapped Potential of
Astrocytes? Retrieved November3, 2021,
fromhttps://www.alzforum.org/news/research-news/av-clearance-untapped-potential-astrocytes
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#样本#
118
转战梅斯
96
谁能攻克AD,谁就是下个诺贝尔奖获得者。
112
老年性痴呆,未来还是希望借助神经电生理吧,也许更为有效!
104