炎症反应在瘢痕疙瘩形成中的作用机制
2024-09-13 海龙话皮 海龙话皮 发表于上海
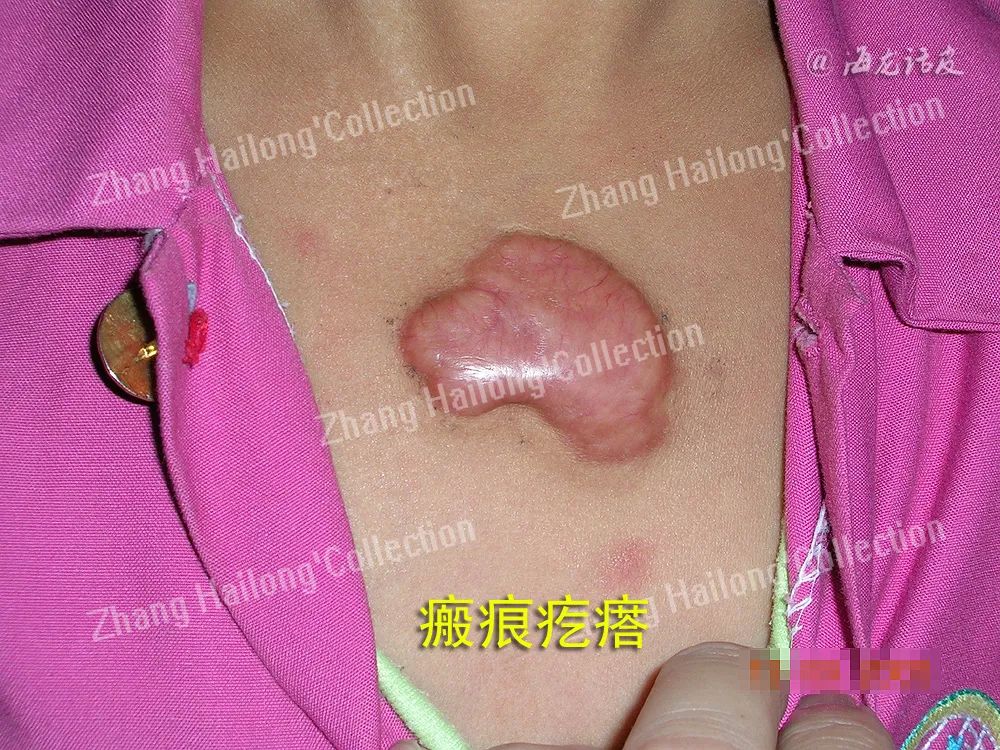
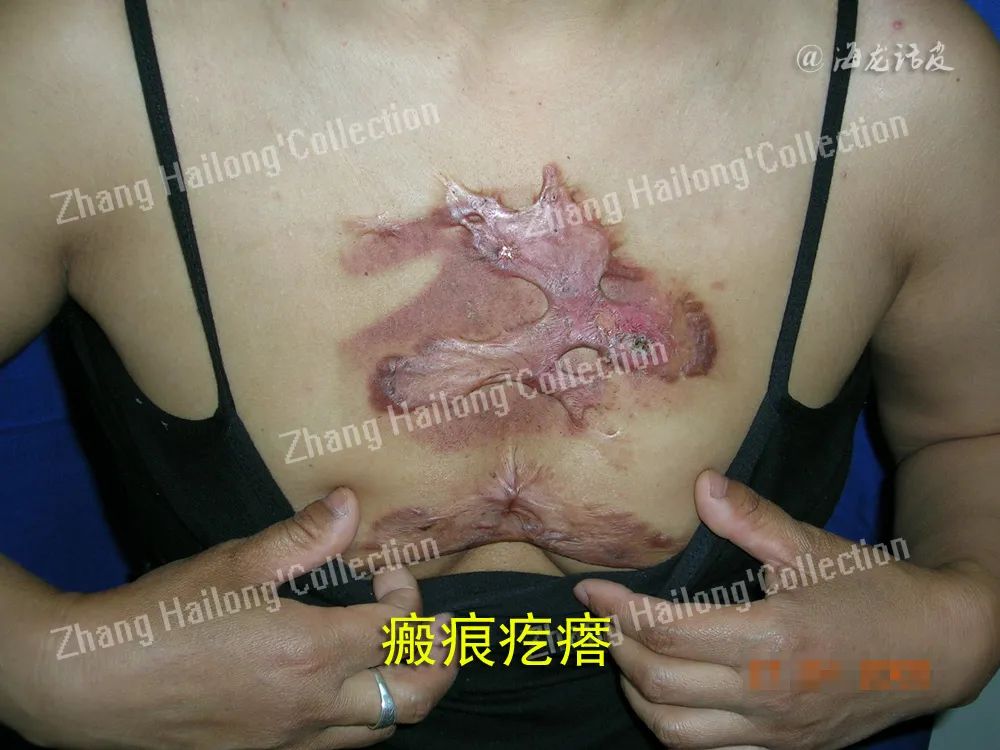
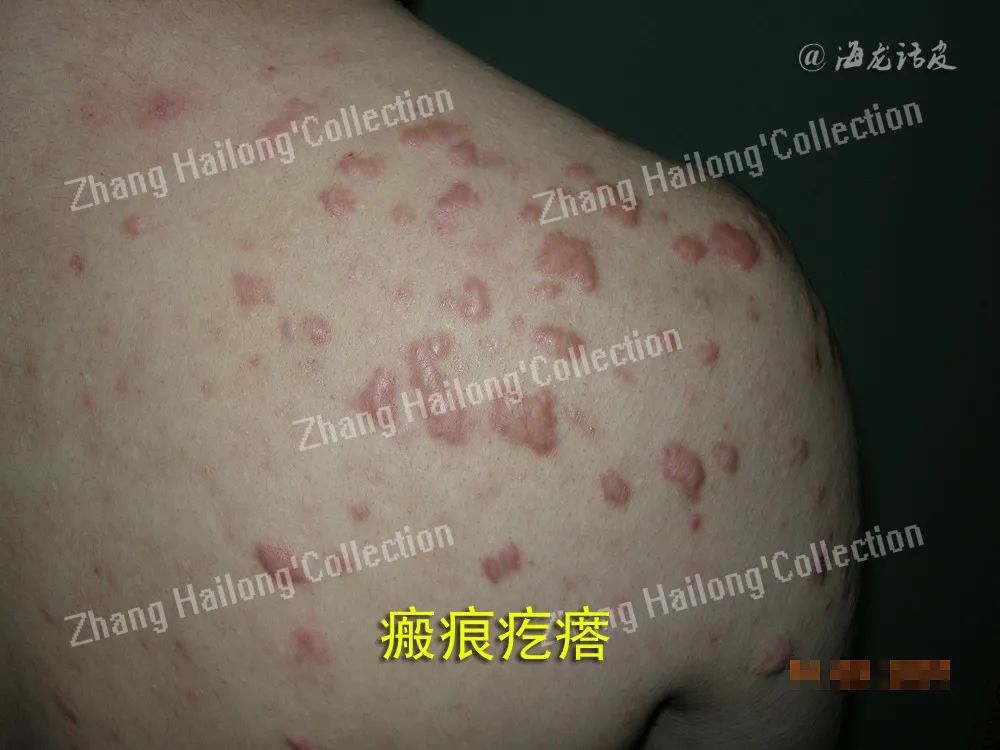
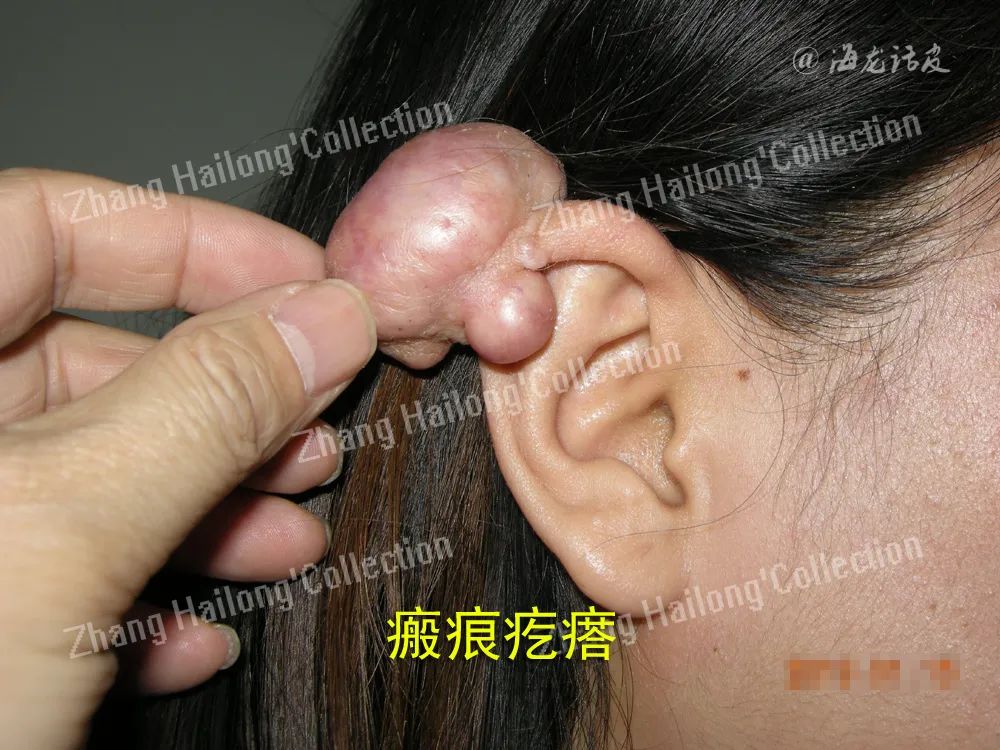
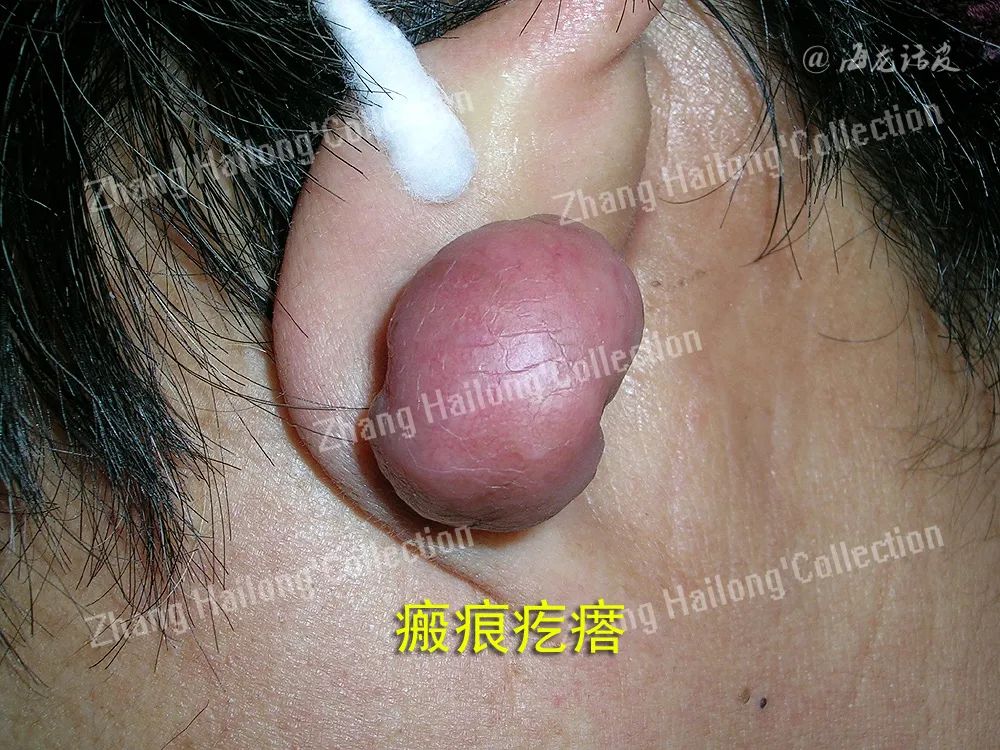
瘢痕疙瘩形成过程中经历了异常的炎症反应,主要是由炎症细胞、成纤维细胞及炎症因子等相互作用导致的。探究炎症与瘢痕疙瘩的关系,可能找到有效治疗瘢痕疙瘩的新靶点。
瘢痕疙瘩是皮肤损伤后组织异常修复的结果,发病机制复杂,临床治疗效果不理想。瘢痕疙瘩形成过程中经历了异常的炎症反应,主要是由炎症细胞、成纤维细胞及炎症因子等相互作用导致的。探究炎症与瘢痕疙瘩的关系,可能找到有效治疗瘢痕疙瘩的新靶点。
炎症细胞
中性粒细胞
当皮肤受到损伤时,皮肤屏障功能被破坏,损伤的组织释放警告信号,如趋化因子(CXC)L8、CXCL2、血小板生长因子(PDGF)和血管内皮生长因子(VEGF)等,这些报警信号从血液循环中招募各种免疫细胞,并刺激局部常驻免疫细胞增殖,导致损伤部位集结中性粒细胞、巨噬细胞、肥大细胞和T淋巴细胞等。中性粒细胞最早到达损伤组织,主要作用是抗感染,通过吞噬和脱颗粒产生高浓度活性氧(ROS)和形成中性粒细胞胞外杀菌网络(NETs),以阻止微生物入侵伤口,但也有可能会造成周围组织的损伤。
早期中性粒细胞产生细胞因子,如IL-1β、IL-6和TNF-α,促进炎症反应和巨噬细胞活化,之后的中性粒细胞,释放VEGF、金属基质蛋白酶(MMP)-9等促进新生血管形成和胶原沉积,以促进组织修复。中性粒细胞通过凋亡自毁,然后被巨噬细胞迅速识别和清除。
NISHIO等发现,老龄C57BL/6小鼠伤口愈合相对缓慢,用抗粒细胞分化抗原(Gr-1)抗体消耗中性粒细胞显著延迟了老龄小鼠的伤口愈合,静脉注射粒细胞集落刺激因子(G-CSF)增加了中性粒细胞后促进伤口愈合,此处理对幼龄小鼠影响较小。同样,随着年龄增长,伤口的愈合会变慢,这与中性粒细胞功能下降,清除感染及吞噬等效率降低有关。中性粒细胞的异常有可能导致瘢痕疙瘩的发生,其对瘢痕疙瘩成纤维细胞的直接和间接作用机制尚需进一步研究。
巨噬细胞
巨噬细胞和炎症在伤口修复过程中起着有益的作用,如清除细胞碎片和病原体,直至细胞外基质沉积、血管再形成和伤口再上皮化。伤口巨噬细胞可分为M1和M2两种表型,M1-M2为连续表型,随着伤口的成熟而进化。当有损伤时,炎性细胞因子如TNF-α和干扰素(IFN)-γ的存在促进循环中的单核细胞与血管内皮细胞的黏附,通过微出血渗漏到伤口处,单核细胞从非常早期(1d)就存在于伤口内,并在3~6d之间达到高峰。
CD14+单核细胞进入伤口过程中转化为M1型巨噬细胞,M1型有很强的吞噬能力,清理细胞碎片和病原体,还产生大量促炎因子,如IL-1β、TNF-α和IL-6,促进炎症反应、刺激胶原蛋白生成和血管生成,启动愈合过程,随着伤口环境改变,M1表型转变为M2表型,由IL-4、IL-13或凋亡的中性粒细胞刺激转化,活化的M2型巨噬细胞产生细胞因子,如IL-10、PDGF、TGF-β、胰岛素样生长因子(IGF)-1和VEGF,刺激角质形成细胞和成纤维细胞的增殖,对纤维化有促进作用,并且通过下调TNF-α和IL-12来抑制促炎性M1巨噬细胞。
JIN等发现瘢痕疙瘩组织中的巨噬细胞呈现高活化状态,并向M2亚型分化,免疫组化显示瘢痕疙瘩组织中浸润的M2比M1更常见,以上提示巨噬细胞的成熟和分化在瘢痕疙瘩形成中起着重要作用。
淋巴细胞
淋巴细胞包括T淋巴细胞和B淋巴细胞,都参与炎症反应。损伤激活炎症反应的开始,T淋巴细胞从损伤附近血管渗出并迁移到伤口中去,在损伤愈合后数量明显减少。有很多研究显示瘢痕疙瘩组织内存在T淋巴细胞(CD4+和CD8+)、T+B淋巴细胞聚集体,主要分布于真皮浅层与瘢痕疙瘩边缘,血管周围也可见T淋巴细胞,而在正常皮肤中T淋巴细胞少见。T淋巴细胞通过分泌细胞因子如IL-4、IL-5、IL-6、IL-10和IL-13促进炎症反应和刺激人成纤维细胞合成胶原蛋白,从而促进纤维化。B淋巴细胞可通过局部效应,如抗原呈递、细胞因子释放(如IL-4、IL-6、IL-13和TGF-β)、和(或)细胞-细胞接触,或通过抗体的长期效应,直接或间接诱导组织纤维化。
肥大细胞
肥大细胞存在于皮肤的真皮和皮下组织层,是先天免疫系统的重要细胞成分,肥大细胞通过吞噬作用和伴随脱粒的活性氧的产生来保护组织免受病原体的侵害,在IgE介导的过敏性炎症中起着重要作用。活化的肥大细胞可以诱导多种物质的分泌,如组胺、蛋白酶和趋化因子,以及多种细胞因子的从头合成,如TNF-α、IL-1β、IL-4、IL-6和TGF-β,这些细胞因子在炎性反应中发挥重要作用,增强T淋巴细胞活化和B淋巴细胞存活。
透射电子显微镜技术显示,肥大细胞可以吞噬胶原蛋白,所以肥大细胞的积累可能是胶原过度合成的继发效应,肥大细胞可以释放多种生长因子, 如TGF-β、成纤维细胞生长因子(FGF)以及VEGF和有丝分裂多肽等,刺激皮肤成纤维细胞形成胶原,导致合成增加的不平衡,进一步加重皮肤纤维化。
也有研究显示成纤维细胞可以产生肥大细胞生长因子,可以调节肥大细胞的存活、分化和颗粒合成。脱粒导致组胺和肝素释放,导致微血管内皮细胞增殖和瘙痒,这可以解释瘢痕疙瘩持续瘙痒原因。ONG等研究发现,与正常人相比,瘢痕疙瘩患者和增生性瘢痕患者的过敏症状发生率显著增加,瘢痕疙瘩患者过敏症状的发生率更高。
炎症因子
IL-1
IL-1家族目前有11个成员,IL-1家族成员与炎症密切相关。IL-1α和IL-1β归属于IL-1亚家族,具有促炎活性。IL-1α相对分子量31KD,是一种"双功能"细胞因子,除了通过细胞表面受体链接作为经典细胞因子发挥作用外,还可以调节基因表达,IL-1α从坏死细胞中释放,与IL-1R结合并快速启动趋化因子和炎性细胞因子的产生,诱导中性粒细胞等炎症细胞聚集,上皮细胞、巨噬细胞、单核细胞和内皮细胞受刺激后可以上调和释放IL-1α。
IL-1β相对分子量35KD,是一种可诱导的细胞因子,在健康细胞或组织中一般不表达,在受到激活信号后成熟并分泌,如病原体或损伤因素,从而启动和促进炎症,包括促进巨噬细胞迁移、激活促炎因子和IL-6、调节趋化因子表达。
研究发现,IL-1β也是导致纤维发生的关键信号,IL-1β通过与IL-1βRs结合在促进纤维化中发挥作用,IL-1β和IL-1βR处于动态平衡状态,IL-1βRs的激动剂可以通过IL-1β促进纤维化,但其拮抗剂可以通过减少IL-1βRs来防止IL-1β促进的纤维化。IL-1β分别通过TGF-β、细胞外调节蛋白激酶(ERK)1/2、c-Jun氨基端激酶JNK和磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt,又称PKB)等途径促进纤维化发生。以上提示IL-1在瘢痕疙瘩发生中可能也存在促炎与促纤维化作用,但此研究较少,尚不能定论。
IL-6
IL-6细胞因子家族可以说是最复杂的相关细胞因子群,影响体内所有主要的生物系统,IL-6家族成员对发育、生殖、组织再生、免疫稳态以及防御和修复感染、创伤或损伤至关重要。IL-6是家族成员之一,一种单链糖蛋白,相对分子量21~30KD,是一种功能广泛的多效性细胞因子,可以调节细胞的分化、生长、存活和效应器功能,在炎症过程中有着促进作用,主要由巨噬细胞、单核细胞、活化T淋巴细胞及成纤维细胞产生,可刺激炎症细胞聚集。
IL-8
IL-8是趋化因子家族中的一种细胞因子,也称为CXCL8,相对分子量约8KD,由多种免疫和非免疫细胞产生,是中性粒细胞趋化剂,IL-8通过与其受体CXCR1/2结合发挥作用,可活化中性粒细胞,引起炎症反应,刺激细胞增殖、胶原合成和细胞外基质沉积。在肺纤维化的研究中,IL-8可以通过自分泌和旁分泌的方式促进巨噬细胞的增殖和运动,促进纤维化。
IL-10
IL-10家族细胞因子按功能能分为3个亚组,IL-10是其中之一,IL-10是约为35KD的多肽细胞因子,由各种白细胞分泌,如巨噬细胞、自然杀伤细胞、T淋巴细胞、B淋巴细胞、树突细胞和中性粒细胞,IL-10在抑制促炎细胞因子的产生中起着关键作用,在瘢痕形成和其他纤维化相关疾病中也起重要作用,LIECHTY等发现IL-10缺陷小鼠在胎儿伤口愈合方面显示出明显炎症和瘢痕形成,GORDON等发现,IL-10在妊娠中期的人胎儿皮肤中高度表达,而在出生后的人皮肤中缺乏表达,该研究者还发现了腺病毒介导的IL-10的过度表达可以在小鼠切口模型中实现无瘢痕伤口愈合,这可能与IL-10下调促炎细胞因子IL-6和IL-8有关。
TNF-α
TNF-α是一种具有胞内氮末端的Ⅱ型跨膜蛋白,主要由单核细胞、中性粒细胞分泌,也可以由成纤维细胞分泌,参与免疫、炎症反应以及纤维化过程,其中启动炎症反应是其核心作用。TNF-α在损伤和感染部位激活中性粒细胞、巨噬细胞和淋巴细胞,而先形成的TNF-α作为自分泌刺激信号,激活核因子(NF)-κB,进一步诱导TNF-α和其他细胞因子分泌,如G-CSF和IL-8。
MCCAULEY等发现瘢痕疙瘩患者血清TNF-α较非瘢痕疙瘩患者升高,且在瘢痕疙瘩组织中TNF-α表达升高,实验证实TNF-α有刺激瘢痕疙瘩成纤维细胞体外增殖的作用,其机制可能与瘢痕疙瘩成纤维细胞中TNFR1表达增加有关,TNF-α的刺激可能导致NFκB、JNK、p38促分裂原活化蛋白激酶(MAPK)通路的重复激活从而促进瘢痕疙瘩成纤维细胞的增殖。
总结与展望
瘢痕疙瘩是皮肤损伤后异常修复的结果,其中异常的炎症反应起着重要促进作用,在皮肤损伤局部,炎症细胞和成纤维细胞通过各种炎性因子、生长因子相互作用,相互促进,使炎症反应失衡、成纤维细胞过度增殖和细胞外基质的大量堆积,最终促进了瘢痕疙瘩的形成。
由于在伤口愈合至瘢痕疙瘩形成过程中炎症网络复杂,何时开始干预以及治疗靶点的选择仍是难题。理想的治疗措施是在损伤早期实施干预,使炎症反应达到平衡、组织重塑适度,从而实现预防瘢痕疙瘩。未来,随着对各种机制的深入研究,将有助于加快治愈瘢痕疙瘩的进程。
参考文献:
1.万红双,刘艳红,高钟镐等.炎症反应在瘢痕疙瘩形成中的作用机制[J].临床皮肤科杂志,2024,53(9): 571-574.
2.OJEH N,BHARATHA A,GAUR U, et al.Keloids: Current and emerging therapies[J]. Scars Burn Heal, 2020, 6:1-18.
3.RABELLO F B, SOUZA C D, FARINA J J. Update on hyper-trophic scar treatment[J]. Clinics(Sao Paulo), 2014, 69(8):565-573.
4.其他文献(略)。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#炎症反应# #瘢痕疙瘩#
63