British Journal of Cancer:肿瘤诊断治疗新方法
2023-08-14 小桔灯网 小桔灯网 发表于上海
在这篇文章中,作者利用多组学方法描述了放射基因组学在精准医学中的应用,概述了放射基因组学在肿瘤诊断、治疗计划和评估方面的主要应用,目的是发展个性化的医学。
影像组学是一个快速发展的领域,它允许将放射摄影图像进行数字解码,获得定量信息,如强度、纹理、形状和尺寸指标,然后对这些数据进行过滤、聚类和分析,以识别和预测肿瘤异质性。随着我们进入精准医疗和大数据的下一个时代,许多专家提出了“放射基因组学”的概念。放射基因组学侧重于发展医学成像和基因组数据之间的多尺度连接,通过将肿瘤表型的定量成像特征与基因组特征联系起来,开发无创预后和诊断方法来识别治疗的生物标志物,特别是癌症。
近日,一组来自中国的研究团队在杂志British Journal of Cancer上发表了一篇题为“Radiogenomics: a key component of precision cancer medicine”的综述文章。在这篇文章中,作者利用多组学方法描述了放射基因组学在精准医学中的应用,概述了放射基因组学在肿瘤诊断、治疗计划和评估方面的主要应用,目的是发展个性化的医学。最后还讨论了放射基因组学领域的挑战以及这些方法的范围和临床适用性。

图片来源:British Journal of Cancer
一、放射基因组学工作流程概述
放射基因组学的核心思想是将反映分子水平活动的基因组数据与反映定量疾病表型的成像数据融合,建立基因组与图像特征之间的联系,通过对基因组和成像信息的分析和提炼,深入了解疾病的遗传背景和发展。
放射基因组工作流程包括以下步骤:
(i)图像收集,包括x线摄影,超声,磁共振成像(MRI)和PET/CT;
(ii)图像分割;
(iii)图像特征提取与识别,即提取高维特征数据,定量描述感兴趣区域(ROI)的属性;
(iv)特征选择和模型构建;
(v)临床应用,影像组织学应用最多,包括肿瘤分类、肿瘤分期和预后预测(如下图)。
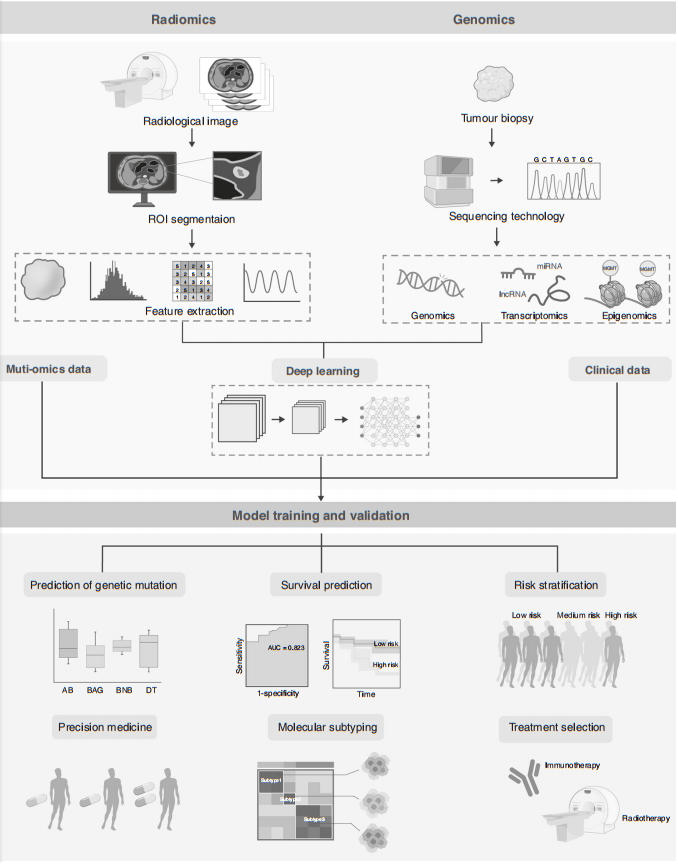
影像组学与其他组学数据相结合以构建极其准确的预测模型的示意图。图片来源:British Journal of Cancer
二、放射基因组学的几个主要分支
01 利用放射基因组模型预测突变基因
Seibold等利用放射基因组学对1883例乳腺癌患者4个基因中10个最重要的单核苷酸多态性(SNP)进行了评估,发现XRCC1中的rs2682585与晚期皮肤毒性和总体毒性反应密切相关。
在非小细胞肺癌(NSCLC)中,EGFR突变和ALK重排是TKIs治疗NSCLC患者的重要生物学指标。有多组研究证实,提取PET或CT成像特征,结合临床变量建立预测模型,对EGFR具有较高的预测能力。结直肠癌(CRC)患者KRAs突变状态的成像基因组学研究也引起了广泛的兴趣。多项研究发现,息肉形态、轴向长度增加、轴向纵向比增加、N2淋巴结状态与KRAS突变有关;转移灶质地参数与肿瘤分级、血清癌胚抗原(CEA)和KRAS突变状态相关。上述研究表明,常规影像学特征特征具有良好的预测作用基因突变在几种癌症中的价值。然而,由于许多尚未发现的放射性敏感SNP,临床应用可能受到限制。
02 影像组学在转录组学中的应用
转录组学可用于医学,以更好地了解健康人与病人之间基因表达的差异。通过研究哪些基因被激活,哪些基因被关闭,以及在哪些人群中,研究人员可以了解基因表达的变化如何影响疾病的进展。转录生物标志物可将透明细胞性肾细胞癌(ccRCC)分类为具有临床意义的分子亚群。有一项研究探讨了与PET/CT成像表型相关的转录组学分子特征及其与肝细胞癌存活的潜在关系。同样,Yamamoto等人使用放射基因组关联图将MR图像表型与乳腺癌的整体基因表达模式联系起来,以了解乳腺癌的潜在分子生物学。
03 影像组学和表观遗传学的结合
表观遗传改变如何驱动癌症形成是癌症研究中一个备受关注的领域,因为表观遗传修饰是可逆的,因此是有吸引力的干预目标。为了研究ccRCC的CT影像特征、RUNX3甲基化水平与生存之间的关系,Cen等发现肿瘤边缘模糊、左侧肿瘤和肿瘤内血管的存在可显著预测RUNX3甲基化水平的升高。此外,Kanas等证明了胶质母细胞瘤术前标准MRI变量与MGMT甲基化状态之间的关联。
三、临床应用
01 影像学表型与分子表型的关系
Perou等人首先提出了乳腺癌分子亚型,包括luminal A、luminal B、HER2-enriched和basal -like(如下图)。Mazurowski等发现了23个DCE-MRI特征,揭示了luminal B乳腺癌与动态增强特征之间的联系。Xie等采用多参数MR成像和全肿瘤直方图分析将三阴性乳腺癌与其他乳腺癌亚型区分开来,在鉴别三阴性乳腺癌与Luminal A和HER2-enriched亚型方面具有良好的准确性。髓母细胞瘤(MB)被公认为四个不同的分子亚群——SHH、WNT、group 3和group 4。术前多参数MRI提取的常规成像特征与MB的分子亚群相关,可以可靠地预测SHH和group 4髓母细胞瘤的分子亚型。
02 放射基因组学作为评估肿瘤治疗效果和选择治疗方案的工具
免疫治疗: 18F-FDG-PET/CT成像基因组学被应用于预测PD-1/PD-L1表达。最近的一项研究发现,DLS(深度学习评分)可以作为通过IHC测定的PD-L1指标的替代。同样,Dall'Olio等表明,总代谢肿瘤体积(tMTV) ≥75cm3可能是使用派姆单抗治疗的晚期非小细胞肺癌和PD-L1高表达患者预后不良的生物标志物。
新辅助全身治疗: 新辅助全身治疗(NST)是局部和晚期乳腺癌的标准治疗,确定可以从NST治疗中获益的患者是至关重要的。病理完全缓解(Pathological complete response, pCR)与长期良好预后密切相关,可作为评估NST治疗有效性的指标。Tsukada等预测了NST完成后肿瘤是否达到pCR,并揭示了两个MRI特征(tumour growth direction和contouring rate)与pCR相关。Kim等用无复发生存期评价乳腺癌的预后,发现T2WI具有高熵(高异质性)的患者显著降低无复发生存率。
放疗: 放射基因组学可以提供一个包含影像学和遗传学维度的综合模型,以协助临床决策。首先,放射基因组学可以预测癌症放疗的不良反应并识别遗传标记,从而促进基于遗传因素和其他肿瘤特征的最佳治疗方案的选择。其次,现在的放疗技术已经从二维放疗发展到三维甚至四维放疗技术;放疗剂量分布也从点剂量发展到体积剂量分布等。这些新的放疗技术需要大量的影像学数据作为基础。放射组学技术能够实现详细和准确的图像表型,并在广泛的实体肿瘤中证明肿瘤内的异质性。第三,提取多组学特征并将其纳入物理模型,这有助于指导放射治疗物理学家在靶向治疗中增加再照射方案。
预测药物反应和潜在耐药性:放射基因组学也可用于预测药物反应和潜在耐药性,指导肿瘤的个体化治疗。早在2007年,Kuo等发现增强CT特异性影像学表现与肝细胞癌对阿霉素的敏感性有很强的相关性。放射基因组学可以为单个异质肿瘤提供逐体素的遗传信息,或者在转移性疾病的情况下,为癌症集合提供遗传信息,支持个性化治疗方案的制定。
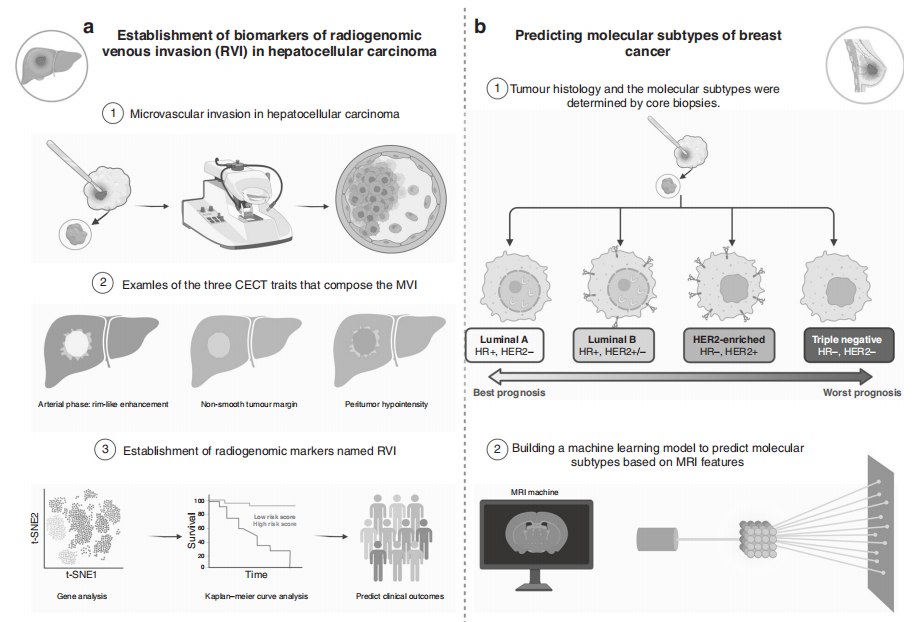
放射基因组学在治疗肝细胞癌和乳腺癌临床实践中的应用。
图片来源:British Journal of Cancer
03 放射基因组模型作为预测预后和复发的临床生物标志物
通过融合影像学、遗传学和病理学特征建立放射基因组学标签,揭示了影像学与患者预后之间的联系(如下图)。放射基因组静脉侵犯(RVI)是对比增强计算机断层扫描(CECT) MVI的生物标志物。Banerjee等评估了RVI,发现RVI可以有效地识别那些不太可能从手术治疗中获得持久益处的个体。
多基因检测预测肿瘤复发风险已在临床实践中得到应用,如Oncotype Dx和PAM50。研究发现乳腺密度与Oncotype Dx复发评分(ODxRS)呈负相关,肿块边缘不清、线状分支钙化延长与较高的ODxRS显著相关。Li等使用多种基因检测(MammaPrint、Oncotype DX和PAM50)检测乳腺MRI表型,发现影像学组织学特征(尤其是肿瘤大小和增强纹理)与多种基因检测的复发评分之间存在显著相关性。
肾癌的首个放射基因组风险评分(RRS)由Jamshidi等人创建,包括四个CT成像特征(肿瘤坏死、过渡区浸润、肿瘤边缘不连续增强和肿瘤边缘减弱)。一些研究证实了RRS可作为疾病特异性生存指标,并且RRS与生存呈负相关。
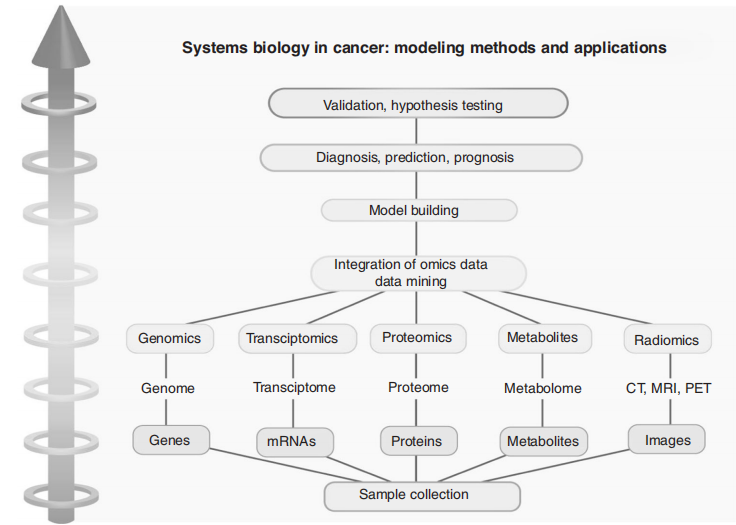
癌症诊断和预后的系统生物学方法。
图片来源:British Journal of Cancer
当前放射基因组学临床实践中的挑战
首先,由于影像学图像中存在成千上万的定量特征,因此需要稳健的深度学习算法来开发可靠的模型。曾有研究评估了多种机器学习算法用于癌症患者模型的训练。作者强调了对每种癌症采用适当的机器学习策略的重要性。然而,过多的特征可能包含冗余或不必要的数据,导致过度拟合。
第二,放射基因组学分析主要局限性涉及特征提取的可变性和缺乏可重复性。有研究发现从CT图像中提取的177个放射学特征中,只有71个是可重复的;由于冗余信息,只有10个特征被保留;一阶特征比形状度量和纹理参数更具可重复性,熵是最稳定的一阶特征之一。因此,未来的放射组学研究可以从标准化的成像方法中获益,包括剂量给药、采集参数。
第三,基因表达和信号通路极其复杂,测序费用昂贵且复杂,限制了大规模成像基因组学的研究。第四,缺乏一致的标准也影响了特征提取和图像相关分析。例如,软件和成像设备的差异,机构之间和机构内部数据集的差异,以及ROls分割方法的差异,都可能影响特征提取。
最后,大多数研究都是小样本量的回顾性研究。另一方面,为了评估各种肿瘤特征与相关基因之间的联系,大多数研究依赖于单中心患者队列。当样本不足时,训练、验证和测试数据集的分层是不充分的,这对模型适应、优化和评估过程有不利影响。
讨论及观点
首先,全球研究团队可以使用前瞻性的多中心临床试验和大量共享放射基因组学数据集来制定和评估创新的放射基因组学策略。为了建立一个强大的癌症放射组学成像数据库,研究人员必须能够不受限制地获取基因表达、分子特征和放射组学数据等材料。
第二,规范分析方法和形象收集技术对于跨机构的再现性至关重要。北美放射学会和定量成像网络(QIN)正在建立共识标准和数字幻影促进放射基因组学的临床应用。
第三,放射基因组学研究容易出现过拟合和/或选择偏差,而更好的算法(如深度学习、神经网络)的不断出现可能会优化数据。深度学习特征和预测模型的可视化可能有助于解决这一问题。研究人员应根据统一的评估标准和报告指南来评估放射组学的质量,以增强未来放射基因组学模型的稳健性和通用性。此外,透明报告个体预后或诊断的多变量预测模型(TRIPOD)可以为作者提供开发或验证预测模型的额外指导。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言