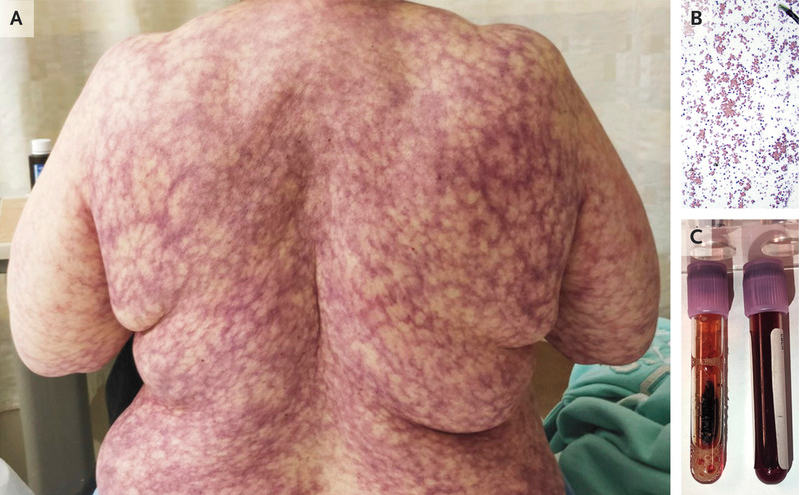
网状青斑(livedo reticularis,LR)是一种常见的皮肤科疾病,好发于四肢,表现为暗红色或青紫色网状斑,呈连续或断裂状分布。其病因和发病机制复杂,可分为生理性、特发性和继发性网状青斑。近年来研究表明,继发性网状青斑可能与抗磷脂抗体综合征、Sneddon综合征、结缔组织病、血管炎、血液系统疾病、栓塞、遗传、药物、感染等多种疾病相关。
系统性疾病
1.抗磷脂抗体综合征
LR是抗磷脂抗体综合征(antiphospholipid syndrome,APS)最常见的皮肤表现,见于8%~40%的APS患者,儿童APS患者中LR比例高达62%。据报道,LR是预测APS系统性血栓事件的标志物,与脑血管意外、偏头痛、癫痫、动静脉血栓形成等事件存在相关性。因此,LR患者除完善抗心磷脂IgG/IgM抗体、抗β2-糖蛋白1IgG/IgM抗体和狼疮抗凝物等检测外,还应全面评估和随访血栓形成事件。
2.Sneddon综合征
Sneddon综合征是一种以LR和脑血管事件为特征的疾病,发病率约为0.0004%,常见于20~42岁女性。多数患者为特发性,极少数与遗传因素有关,发病机制尚不明确。Sneddon综合征的LR呈分布广泛,常见于下肢(98%)、上肢(77%)、躯干(65%)、臀部(15%)、面部(14%)等部位。
其神经系统表现包括脑卒中、短暂性脑缺血发作、认知功能障碍、头痛、癫痫等,而LR通常早于脑血管事件数年出现。40%~50%的Sneddon综合征患者伴有aPL阳性,而aPL阳性和阴性的患者临床表现不同:aPL阳性患者的癫痫发作频率、二尖瓣反流比例更高,对抗凝治疗反应更好;aPL阴性患者的LR分布更广泛,对抗血小板治疗反应更好。
3.结缔组织病
LR可继发于多种结缔组织病,目前已报道的包括系统性红斑狼疮(systemic lupus erythematosus,SLE)、皮肤型红斑狼疮、干燥综合征、类风湿关节炎、皮肌炎、混合性结缔组织病等疾病。部分SLE患者伴有aPL阳性,aPL阳性较aPL阴性的SLE患者更易出现LR。此外,LR是SLE患者中枢神经受累的危险因素之一,可能与神经精神性狼疮的局灶性表现相关。Verdelli等研究纳入619例皮肤型红斑狼疮患者,发现3.7%患者伴有LR,且LR与抗ENA抗体和抗Ro/SSA抗体呈相关性。
4.血管炎与血管病
多种中小血管炎病变伴有LR,其中最多见的为皮肤型结节性多动脉炎(cutaneous polyarteritis nodosa,cPAN)和淋巴细胞性血栓性动脉炎(lymphocytic thrombophilic arteritis,LTA)。cPAN皮疹表现为疼痛性结节、紫癜、溃疡和LR,可伴有周围神经病变,无系统受累,皮肤活检示中小血管以中性粒细胞为主的炎细胞浸润。LTA曾被认为是cPAN的惰性非结节病变亚型,近期研究表明,LTA是一种原发性淋巴细胞性血管炎,呈慢性病程。其LR比cPAN更常见(88% vs.69%),分布更广泛(93%vs22%),压之可褪色,无网状紫癜、
溃疡、结节等病变,38%LTA患者伴有血栓相关指标异常,组织病理示中小血管炎症,以淋巴细胞浸润为主,上述临床和病理学特征可与cPAN进行鉴别诊断。此外,LR在Wegener肉芽肿病、显微镜下多血管炎、Churg-Strauss综合征、Buerger病、荨麻疹性血管炎等中小血管炎中均有散在病例报道。
青斑样血管病是一种慢性复发性皮肤病,网状紫癜、不规则溃疡和白色萎缩是其特征性皮损表现。该病好发于中青年女性,夏季易复发或加重。LR见于多数青斑样血管病患者,可局限于双下肢,也可广泛分布于躯干和四肢。青斑样血管病伴有广泛分布的LR时,需与冷球蛋白血症、cPAN、LTA等多种疾病进行鉴别,病理提示血管内血栓形成、管壁纤维蛋白样变性、而无血管炎表现时可明确诊断。既往该病治疗多以糖皮质激素为主,长期疗效不理想,最新研究表明该病可能与凝血、纤溶等机制相关,利伐沙班、低分子肝素等抗凝治疗后患者恢复良好,但LR缓解不明显。
5.血液性疾病
冷球蛋白血症常表现为雷诺现象、LR、紫癜、溃疡等,寒冷环境下加重,观察血清在4℃环境下的冷沉淀情况可进行诊断。3%~25%冷纤维蛋白原血症患者伴有LR,多为特发性,少数继发于病毒感染、自身免疫病、血液系统疾病、肿瘤等。
冷凝集素综合征是一种IgM冷抗体介导的自身免疫性溶血性贫血,好发于中老年患者,寒冷环境下出现紫红色LR,冷凝集素试验和直接抗人球蛋白试验可辅助诊断。原发性血小板增多症和真性红细胞增多症等骨髓增生性疾病也可出现LR,其发病机制可能与微血管内血栓形成有关。此外,蛋白C或S缺乏症、抗凝血酶III缺乏症、高同型半胱氨酸血症等血液高凝状态均被报道可能与LR相关。
6.栓塞性疾病
胆固醇栓塞综合征是由于动脉粥样硬化斑块破裂引起胆固醇结晶脱落,导致远端微动脉栓塞的临床综合征。LR是其最常见的皮肤表现,此外还可伴有足趾破溃、肾功能不全、嗜酸性粒细胞增多等。源于腹主动脉的粥样硬化斑块最常见,导致躯干和双下肢出现LR。而面部LR非常罕见,Eberl等曾报道1例由颈动脉粥样硬化斑块脱落引发的面部LR:其LR分布于单侧面部,皮损病理活检示血管内微血栓形成伴胆固醇裂隙,予抗血小板治疗后面部LR完全缓解。
在终末期肾病阶段,原发性高草酸尿症和钙化防御可诱发LR,发病机制可能与皮肤微血管内晶体栓塞有关。LR是减压病的常见症状,Hartig等研究发现减压病相关LR与心脏由右向左分流密切相关,气泡引起皮肤动脉血管阻塞引起LR。除上述结晶、气体等物质外,医源性物质也会诱发LR,目前已报道的有介入术的亲水性聚合物凝胶、聚乙烯醇栓塞微球、硅胶或透明质酸等。
7.遗传性疾病
腺苷脱氨酶2缺乏症是一种常染色体隐性遗传病,由ADA2基因突变引起,主要累及皮肤和中枢神经系统。Barron等研究发现,该病可分为三种临床亚型:血管炎型、免疫失调型和血液学异常型,其中LR(74%)是血管炎型最常见的皮肤表现,其后依次为结节性多动脉炎(57%)、雷诺现象(22%)、疣(19%)和皮肤溃疡(5%)。干扰素基因刺激蛋白相关婴儿期起病的血管病是一种I型干扰素病,由TMEM173基因突变引起,其临床表现包括皮肤病变、间质性肺病、全身持续性炎症和发育迟缓等。
LR是其特征性皮肤病变之一,主要累及四肢,局部活检示微血管血栓形成和血管周围中性粒细胞浸润。pry-van Bogaert综合征与Sneddon综合征相似,均有LR和脑血管事件,区别在于:pry-van Bogaert综合征多见于男性,青少年发病,无抗磷脂抗体阳性,脑血管造影提示特征性血管瘤病。目前也有个案报道称Warsaw Breakage综合征、Ehlers-Danlos 综合征、原发性辅酶Q10缺乏症、神经纤维瘤病等患者出现LR样皮疹,但例数较少,尚不能说明与LR的相关性。
8.其他
烟雾病是一种罕见的脑血管病,其特征是颈内动脉进行性狭窄,约12.8%烟雾病患者伴有LR,可能与血管舒缩障碍有关。少数案例报道恶性肿瘤伴发LR,包括印戒细胞胃癌、乳腺癌、尿路上皮癌、多发性骨髓瘤、白血病、淋巴瘤等。
其发病机制尚不明确,部分学者认为是因肿瘤细胞通过真皮淋巴管转移所致,而其他学者认为LR可能与肿瘤团块导致的血管阻塞有关。LR见于急性和慢性胰腺炎患者,位于腰腹部或下肢,可能与胰蛋白酶引起的皮下静脉损伤有关。此外,糙皮病婴幼儿可出现LR,具体机制尚不清楚,补充叶酸和均衡饮食后LR消失。
药物
金刚烷胺是最常报道诱发LR的药物之一,LR的发生率为 8.1%~40%,女性多见,广泛分布于躯干和四肢。其发病机制尚不明确,皮肤组织活检无特征性病理改变。停用金刚烷胺后可观察到LR自行消退,但LR不作为金刚烷胺的停药指征。
米诺环素可诱发抗中性粒细胞胞浆抗体相关血管炎,可能与HLA-DRB1 * 09:01等位基因有关,临床表现为发热、关节痛和双下肢LR,血清学检测示抗髓过氧化物酶抗体阳性,停用米诺环素后LR和全身症状迅速改善。干扰素和去甲肾上腺素均有报道LR作为其罕见并发症,可能与血管舒缩功能障碍有关,停药后LR自行消退。
感染
多位学者回顾性分析新型冠状病毒肺炎的相关皮肤表现,将其分为6种临床模式:荨麻疹样皮疹、融合性红斑-斑丘疹-麻疹样皮疹、丘疹性疱疹、肢端型冻疮样皮疹、LR和紫癜性血管炎。据报道,LR见于2.5%~5.2%新冠肺炎患者,通常为短暂轻微性发作,与血栓栓塞并发症无关。
关于其LR的发病机制,目前有3种假说:神经源性假说、免疫复合物沉积假说和微血栓形成假说,具体致病机制仍待进一步研究。巨细胞病毒也可引起LR,发病机制可能与直接损伤内皮细胞、激活凝血因子和诱导抗磷脂抗体有关。丙型肝炎病毒可通过冷球蛋白血症间接诱发LR。既往个案报道称LR可能与细菌感染相关,包括麻风杆菌、大肠埃希菌、铜绿假单胞杆菌、脑膜炎球菌、链球菌等。肺炎支原体可通过冷凝集素血症诱发LR。此外,梅毒螺旋体和立克次体均有散在案例报道出现LR。
结语
以LR为皮肤表现的疾病种类繁多,临床易漏诊、误诊,早期明确病因有助于制定个体化的治疗方案。病史采集通常包括:诱发或缓解因素、持续时间、自觉症状、可疑用药史、介入手术史、既往病史和家族史。体格检查重点关注LR的分布部位和对称性,检查周围有无溃疡、结节、紫癜、白色萎缩等体征。实验室检查方面,血常规、血沉、C反应蛋白、乙肝两对半、丙肝抗体、结核感染T细胞斑点试验等有助于排除感染性疾病,完善抗核抗体谱、抗心磷脂抗体、抗β2-糖蛋白1抗体、狼疮抗凝物等有助于排除自身免疫性疾病,完善抗中性粒细胞胞浆抗体、冷球蛋白定性实验、冷凝集素实验、免疫固定电泳等有助于排除血管炎相关疾病,必要时完善基因检测排除遗传性疾病。
皮肤组织活检方面,生理性和特发性LR通常无特征性改变,继发性LR部分可见血管周围大量中性粒细胞或淋巴细胞浸润(血管炎)、血管壁钙化沉积(钙化防御)、血管内血栓形成(青斑样血管病)、晶体沉积(原发性高草酸尿症)、胆固醇裂隙(胆固醇栓塞综合征)等特征性改变,有助于进一步明确诊断。但皮肤活检检出率较低,通常选取LR中央白色区域,多次重复活检有助于提高诊断率。
参考文献:
[1]赵晨静,冯素英.网状青斑的病因学研究进展[J].中国皮肤性病学杂志,2022,10(20):1-8.
[2]冯素英,荆可,赵晨静.青斑样血管病64例皮损特点分析[J].中华皮肤科杂志, 2021, 54(10):856-860.
[3]Ehrmann S. Ein Gefaessprozess bei Lues[J]. Wien Med Wochenschr, 1907, 57:777–82.
[4]Gibbs MB, English JC 3rd, Zirwas MJ. Livedo reticularis: an update[J]. J Am Acad Dermatol, 2005, 52(6):1009-1019.
[5]Torres-Jimenez AR, Ramirez-Nova V, Cespedes-Cruz AI, et al. Primary antiphospholipid syndrome in pediatrics: beyond thrombosis. Report of 32 cases and review of the evidence[J]. Pediatr Rheumatol Online J, 2022, 20(1):13.
[6]Toubi E, Krause I, Fraser A, et al. Livedo reticularis is a marker for predicting multi-system thrombosis in antiphospholipid syndrome[J]. Clin Exp Rheumatol, 2005, 23(4):499-504.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言