Nature子刊:解锁新型通用同种异体CAR -T细胞免疫逃避新方法
2022-08-02 上海细胞治疗工程技术研究中心 网络
这种方法的一个潜在优势是节省内源性免疫效应物,并允许它们与CAR- T细胞协同工作,以对抗难以治疗的癌症,包括实体瘤。
众所周知,通用CAR- T细胞疗法具有彻底改变某些恶性血液病的潜力,然而,在同种异体环境中,其可以杀死靶肿瘤细胞,产生宿主抗移植物反应(HvG)与移植物抗宿主反应(GvH)。虽然通过抑制CAR -T细胞中T细胞受体T αβ (TCRαβ)的表达可以预防GvH,但是HvG的预防仍然是一个主要的挑战。
然而,6月30日,Cellectis公司在nature communications上发表了一项有望预防HvG的研究。在这项研究中,Cellectis的科学家们通过同时破坏和重新利用内源性TRAC和B2M位点,生成表达CAR结构和自然杀伤(NK)抑制剂HLA-E的TCRαβ-和HLA-ABC缺陷T细胞。使其在1类主要组织相容性复合体(MHC-1)中的含量偏低,并赋予它们对同种反应性NK细胞和T细胞的免疫逃避特性。

研究数据表明:
通过TALEN介导的基因编辑和腺相关病毒(AAV)依赖性基因插入赋予通用CAR -T细胞高效和特异的免疫逃避特性,可转移至不同的CAR构建体,并适用于常规CAR -T细胞生产过程。
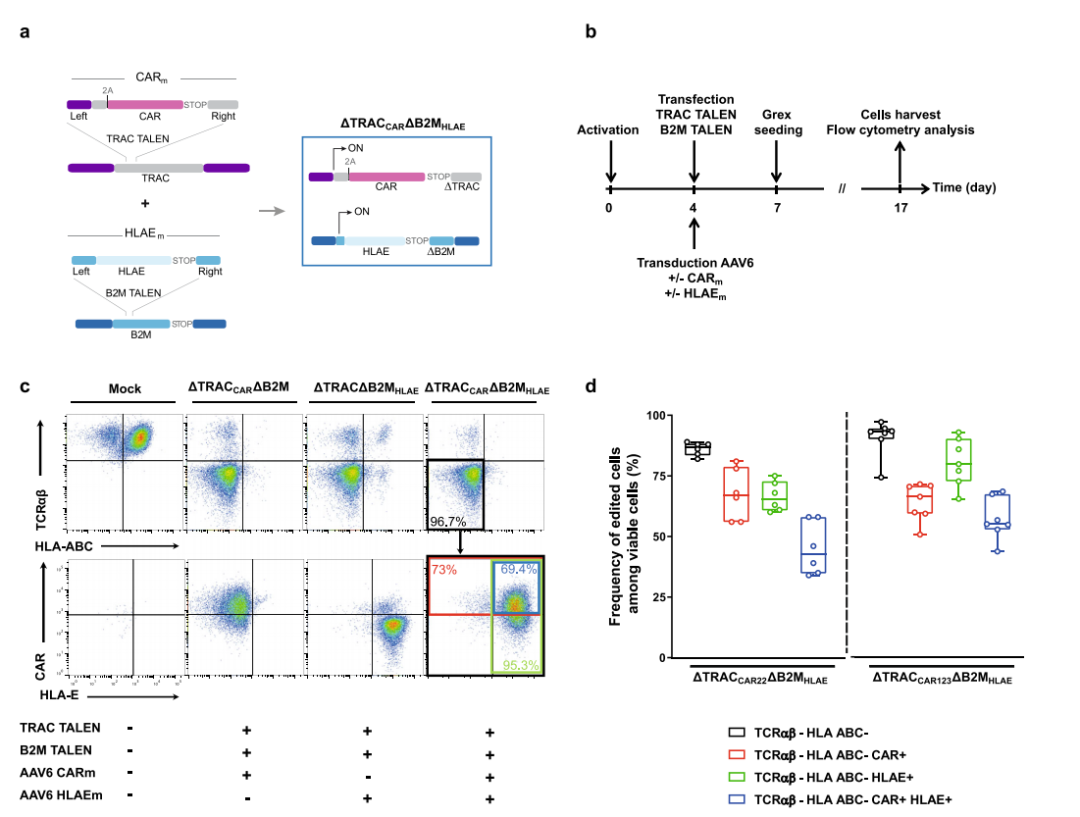
▲ TALEN介导的多重编辑可以在TCRαβ/B2M双敲除T细胞中有效地表达CAR和HLA-E 图片来源:参考资料2
免疫逃避性通用CAR -T细胞可克服同种反应性T细胞和NK细胞的攻击,甚至在高活性NK细胞毒性水平下表现出延长的抗肿瘤活性和持久性。
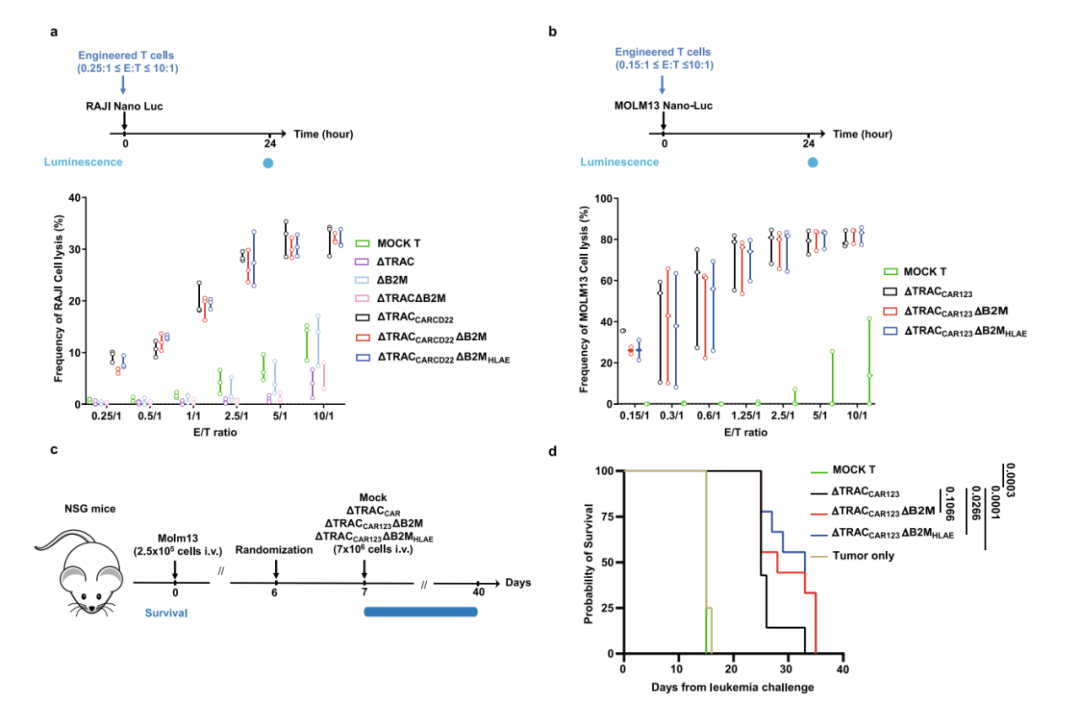
▲ HLA-E在B2M位点的破坏性靶向插入不影响ΔTRACCARΔB2MHLAE的抗肿瘤活性 图片来源:参考资料2
值得注意的是,研究发现大多数健康供体和急性髓系白血病(AML)患者对NK细胞的免疫回避特性相似,表明这种低免疫原性方法的稳健性和可持续性,值得在临床前和临床环境中进一步评估。
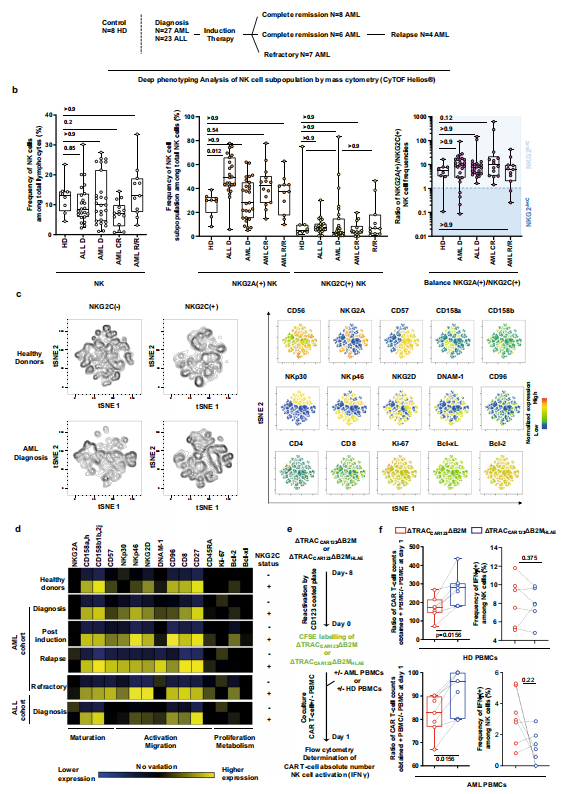
▲ 来自健康供体和接受标准诱导化疗的AML或ALL患者的NK细胞的深度表型和功能特征 图片来源:参考资料2
Cellectis公司副总裁Julien Valton博士说“这种工程方法非常有前途,可以使通用的CAR- T细胞暂时对NK和同种反应性T细胞“隐蔽”,使它们能够在被患者的免疫系统排斥之前根除肿瘤细胞。这将使通用CAR -T细胞在同种异体环境中得到广泛应用,造福于更多的患者。”
Cellectis公司另一位博士Laurent polo补充说“这种方法的一个潜在优势是节省内源性免疫效应物,并允许它们与CAR- T细胞协同工作,以对抗难以治疗的癌症,包括实体瘤。”
实践中的问题
现阶段通用型CAR-T(UCAR-T)在血液恶性肿瘤中的应用主要针对复发性和难治性性肿瘤,通用CAR-T细胞疗法的使用可能提供简化工程细胞制造,甚至可能允许创建“现货”产品,促进更快速和更便宜的治疗面对该类肿瘤。但在实际应用中,该疗法也面临以下两个主要问题:移植物抗宿主病 (GVHD)与移植排斥反应。
现阶段解决策略
使用其他亚型T细胞改善
1.干细胞移植供体的同种异体CAR- T细胞
可从胚胎干细胞和诱导多能干细胞(IPSC)中产生T细胞。胎盘源性干细胞可用于产生T细胞或自然杀伤细胞,胎盘具有独特的人类白细胞抗原(HLA)表达模式。与其他组织有所不同,绒毛外细胞滋养层细胞只表达HLA-C、HLA-E和HLA-G,不过这些特异性对胎盘源性T细胞的影响还没有报道。
此外,IPSC也可以是CAR-T细胞的来源,一个具有共同HLA单倍型的iPSCs库可以用来降低CAR-iPSCT细胞异基因排斥的风险。iPSCs的一个优点是CAR- T细胞由一个多能干细胞系产生,因此是同质的。
2.使用病毒特异性记忆T细胞
在正常细胞/组织在病毒感染后,特异性分化的T细胞,具有识别和杀死受感染细胞的能力,且能介导其他免疫细胞激活病毒,这种T细胞可以预防没有GVHD临床症状的病毒性疾病。
3.黏膜相关恒定 T细胞(MAIT)
在人外周血和各组织中均含量丰富,含有恒定的TCR -α链,可通过MHC I相关蛋白-1(MR1)识别抗原,无须通过抗原递呈细胞,具有开发潜力。
同种免疫防御受体(ADR)
此策略使用一种名为Alloimmune Defence Receptor(ADR)的工程受体。ADR识别活化的同种异体反应性T细胞和NK细胞表面上调的4-1BB分子,导致表达ADR的CAR T细胞被激活,并消除受体的同种异体反应性免疫细胞。ADR的表达不会影响CAR-T细胞的效应子功能,因此,这种方法可以为异体CAR T细胞提供一种新武器,它们可以用来抵抗免疫细胞以试图干扰它们对抗肿瘤的作用。
CD47表达
CD47是一种跨膜蛋白,负责介导多种类型的恶性细胞中的“不要吃我”信号。信号调节蛋白-α(SIRPα)被认为是包括巨噬细胞在内的各种免疫细胞上CD47的受体。一旦在其表面表达CD47抗原的肿瘤细胞遇到巨噬细胞,CD47就会与SIRPα结合,从而导致“不吃我”信号的传播,并因此消除巨噬细胞的吞噬作用。基于此,使用同种异体CAR T细胞避免巨噬细胞辅助的CAR T细胞排斥和随后的清除时,可应用该机制。
使用基因编辑方法
因UCAR-T细胞较自体CAR-T细胞对淋巴细胞清除化疗更为依赖,因此仅敲除抗原受体(TCR)、HLA、MCH这类分子不能完全保证UCAR-T在宿主体内的长期存活,现阶段UCAR-T创新药企业多使用基于CRISPR/cas9技术的编辑平台,非基因编辑技术包括shRNA,慢病毒也在应用,通过非/基因编辑技术增强CAR结构设计来改善以上问题最为直接。
参考资料:
1.https://www.biospace.com/article/releases/cellectis-publishes-article-in-nature-communications-unveiling-novel-immune-evasive-universal-allogeneic-car-t-cells-with-potential-for-improved-persistence/
本公众号刊登注有来源:“上海细胞治疗工程技术研究中心”或“上海细胞治疗集团”或原创的各种新闻、信息、专题专栏资料、文章等均为上海细胞治疗集团版权所有,未经授权请勿转载。已经本号协议授权的媒体/媒介(含微信公众号)、网站,在下载使用时必须注明“稿件来源”,违者将依法追究责任。本号未注明稿件来源的图片、文章等稿件均为转载稿,转载出于传递更多信息的目的,繁荣行业发展,并不代表赞同其观点或证实其内容的真实性。如果本号无意之中侵犯了您的著作权,请来函告知,本站将在核实情况后3个工作日内删除。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#同种异体#
108
#Nat#
69
#新方法#
85
学习学习
75
#细胞免疫#
95