印度专利法对药品的“纵容”是历史必然?还是选择保护?
2019-10-24 强森 药渡
每当面对“天价专利药”时,我们总会不由自主的想到印度的“廉价药”,羡慕他们发生频率极高的药品专利强制许可/无效/驳回等。然而,印度国家对于药品的宽泛“纵容”,是经历了怎样的过渡过程?是历史必然还是过度保护?我国是否应该学习采纳?这其中都有哪些利弊?请看本文。
每当面对“天价专利药”时,我们总会不由自主的想到印度的“廉价药”,羡慕他们发生频率极高的药品专利强制许可/无效/驳回等。然而,印度国家对于药品的宽泛“纵容”,是经历了怎样的过渡过程?是历史必然还是过度保护?我国是否应该学习采纳?这其中都有哪些利弊?请看本文。
1. 先了解~印度专利法发展历程
按时间顺序,印度专利保护制度主要经历了以下5个阶段:
阶段一(1911~1970),采用的是殖民时期英国颁布的《专利及设计法》,既保护药物生产过程的方法专利,也保护药品专利。结果:印度99%以上的药品专利和近90%的药品供应由跨国制药企业控制,印度本土制药企业极少,药价居高不下。
阶段二(1970~1995),1970年颁布了建国后第一部《专利法》,其规定对药物实行工艺专利保护,取消产品专利保护。结果:印度制药企业可以随意仿制跨国制药企业的高价专利药而不用担心侵权。
阶段三(1995~2002),1995年印度加入WTO,签署TRIPS协议(成员国必须将药品及其生产方法纳入专利保护范畴)。结果:印度于2005年对《专利法》进行了修改,对药品重新实施专利保护。
阶段四(2002~2005),专利制度的收紧对民众用药可及性造成了巨大威胁,为了平衡药品专利权与本国公共利益之间的矛盾,印度依据《多哈宣言》对药品强制许可进行了重新规定。结果:强制许可下的印度仿制药可以出口到无相关生产能力的地区和国家。
阶段五(2005~至今),药品专利强制许可制度形成后,印度将专利强制许可多次应用于抗癌专利药,以加快廉价抗癌仿制药的快速上市。结果:多次迫使跨国制药企业主动降低药品价格,从而了实现药品专利与本国公共利益之间的平衡,提高了药品的可及性。
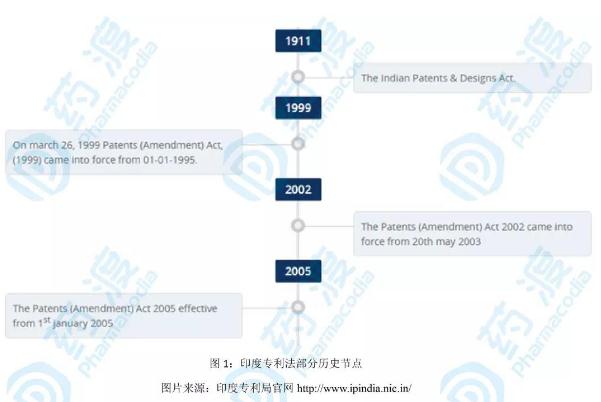
2. 印度专利法更新状态
1970年9月印度政府颁布《专利法》,1972年4月正式生效(PS:该法被认为是现代印度专利法的基础);1999年第一次对《专利法》进行了修改,2000年公布《外观设计法》,2002年再次修改《专利法》,2005年第三次对《专利法》进行了修改。
PS:印度于1994年修订《版权法》,将计算机软件作为文字作品予以保护,并对软件盗版的行为和处罚作了详细说明。而根据新《版权法》,任何使用盗版软件的行为将受到严厉惩罚,使用非法复制的计算机软件将被判处7天至3年的监禁,并课以5.5万至2000万卢比的罚金。印度《版权法》甚至被称为“世界上最严厉的版权法”之一。据此,很多学者将印度的《专利法》与《版权法》作为悖论来进行讨论。

3. 印度专利审批授权状态
通过文献报道:世界知识产权组织2015年3月统计显示,2013年印度发明专利申请总量为43031件,外观设计为8497件,虽然没有我国同期的发明申请量825136件和外观申请量659563件多(我国自2000年后大力鼓励申请专利),但在有统计数据的国家中也算申请量排名较靠前的。
其中,印度本国居民/企业提交申请10669件,外国居民/企业提交申请32362件。PCT申请1320件。在印度,国外专利申请量是其国内申请量的近3倍。在世界知识产权组织统计的所有国家国外专利申请总量的排名中,印度居第6位,足见其市场对外国企业的吸引力。截止2013年,印度有效发明专利量为45103件。
印度专利的审批效率不是很高,积压严重,这一点从申请授权比和待审授权比就可以很清楚的体现。2013年印度专利局在审专利为30988件,待审专利达到141659件。印度专利局2013年的授权量仅有3377件,申请授权比约为13比1,待审授权比约为51比1。专利授权的时间大约为自请求实质审查之日起4年左右。
4. 印度专利法~强制许可/专利无效
印度专利法强调:“一国政府制定专利授予标准、颁发强制许可以及对授予前和授予后异议程序的使用等,都是以扞卫公众健康为目的重要的灵活性措施,符合TRIPS协定”。
而且,印度也不是唯一一个对药品颁发强制许可的国家,包括巴西、厄瓜多尔、厄立特里亚、加纳、印度尼西亚、马来西亚、莫桑比克、泰国和赞比亚在内的许多其他国家都颁发过强制许可,以此确保对廉价药品的获取,满足公共健康的需要。
同时,印度企业通过对政府游说,使改革后的印度专利法中始终保有一个提出异议的条款,即任何企业和个人都可以向印度专利检查部门提出专利无效的异议。利用这一规则,印度制药企业就提出众多项异议申请,使外国制药公司的专利无法在印度生效。

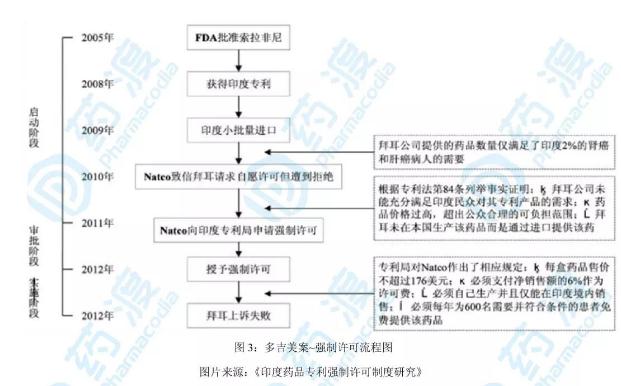
5. 印度首个强制许可—“多吉美案”
印度首次实施强制许可,针对的产品为“多吉美”。
著名制药公司拜耳,研发的多靶点药物~多吉美(索拉非尼)主治晚期肾癌,于2008年获得印度专利,但每月治疗须高达5700美元,而印度人年均收入仅1k美元左右,国民明显负担不起。印度仿制药企Natco通过统计发现,拜耳提供的该药数量仅满足了印度1~2%的适应患者需要。于是,2010年Natco公司致信拜耳愿意以合理的条款和条件获得拜耳的自愿许可,但遭到了拜耳的拒绝,Natco公司遂向印度专利局提出强制许可申请。
2011年8月9日,Natco公司向印度专利局提交了初步证据,认为拜耳提供的专利药未能充分满足印度民众的需求,价格远远超出公众的可负担范围,并且拜耳未在印度本国生产该药而是通过进口提供药品。当日,印度专利局受理了Natco的申请并将其申请书刊登在专利局公报,同时Natco向拜耳提供了申请副本。当年11月18日,拜耳向印度专利局提交了异议申请书。2012年1月13日印度国家专利局举行了听证会,听取双方陈述的事实和理由,基于拜耳公司确实未能以可获得和可负担的标准为该药物定价,而且不能保证该药物在印度有足够的和可持续的供应,印度专利局于2012年3月9日做出授予Natco公司强制许可的决定。
拜耳公司不服印度专利局的强制许可决定,于2012年5月4日向印度知识产权上诉委员会(Intellectual Property Appellate Board,IPAB)提出了上诉,但该上诉被驳回。根据印度专利局的强制许可决定,在2020年索拉非尼专利到期前,Natco公司均可在印度生产和销售该药。同时,专利局也对Natco作出了相应规定,包括:1)该药价格每盒不超过176美元;2)应保留包括销售账户在内的相关记录,每季向专利局和许可方报告销售细节;3)必须支付净销售额的6%作为许可费;4)必须每年为600名需要并符合条件的患者免费提供该药品。从实施效果来看,印度对索拉非尼实施强制许可后其价格降幅达97%,大大增加了药品的可获得性。
6.“特罗凯”~过程复杂/未能幸免
特罗凯(盐酸厄洛替尼片)是由罗氏制药有限公司生产的表皮生长因子受体酪氨酸激酶抑制剂。近年来特罗凯获批了针对EGFR阳性的肺癌及其他癌症的治疗。2006年罗氏将厄洛替尼片以特罗凯商标名引进印度市场,2007年2月罗氏在印度获得厄洛替尼N-(3-乙炔苯基)-6,7-双(2-甲氧乙氧基)-4-喹啉胺盐酸盐的专利授权。由于厄洛替尼可应用于多种癌症的治疗,2006年1月印度西普拉公司宣布其有意出售正在研发的厄洛替尼仿制药Erlocip,2008年1月Erlocip上市。
随后,罗氏以专利侵权起诉西普拉公司并希望颁布临时禁制令阻止西普拉生产、销售、出口特罗凯仿制药Erlocip。西普拉公司提出罗氏公司专利无效的反诉。新德里高等法院认为基于公共利益考虑,拒绝对Erlocip颁布禁制令,同时法院驳回了西普拉公司对罗氏公司专利无效的请求。罗氏随后提出上诉。2012年9月7日,在经过为期4年的几十个听证会后,印度法院驳回了罗氏针对特罗凯专利的专利侵权诉讼。法院认为罗氏主要的权利主张是化合物本身即盐酸厄洛替尼(化学式所描述),此涵盖化合物的主张未限定多晶型特殊变异体。由于罗氏销售的是厄洛替尼的特殊形式(多晶型A和B),而西普拉销售的Erlocip仅是多晶型B,因此西普拉不构成侵权行为。
7.“格列卫”~遭遇驳回
除上述及相关的强制许可、专利无效外,近年来印度对于国外确定以及潜在的天价专利药,采取更多的是驳回、不授权;最典型的是对格列卫β晶型专利申请的驳回。
格列卫(甲磺酸伊马替尼)是瑞士制药巨头诺华开发的白血病药物。1998年诺华向印度提交甲磺酸伊马替尼β晶型的药物专利申请,2006年1月印度专利局驳回该申请,理由是申请未能满足新颖性和非显而易见性。为此,诺华向高等法院提出上诉,此案移交至上诉委员会。上诉委员会于2009年6月作出裁决,修改了印度专利局对该成份在所属领域新颖性和非显而易见性的声明,但以该药不是一个新物质而是已知化合物的改进型,并且诺华未能展示出显着增加该药的疗效为理由,拒绝了诺华的申请。之后诺华根据印度宪法第136条通过特别许可请愿书向最高法院提出上诉,指控印度违反了WTO的专利规则,侵害了自己的利益。
2013年4月1日,印度最高法院驳回诺华公司对甲磺酸伊马替尼β晶型专利保护的要求,理由是诺华公司专利的物质是已知物质,因此不符合印度专利法规定,不具有获得发明专利的资格;另外,最高法院也考查了甲磺酸伊马替尼β晶型与伊马替尼或甲磺酸伊马替尼的疗效差异,认为无显着差异。最终驳回。
8. 综上,业内人士应如何看待?
任何存在的事物,大都存在利弊正反两方面的评价。对于印度在药品方面所采取的“纵容”态度,其积极作用还是很明显的:药价降幅巨大,可及性大大提高;本土企业在仿制技术方面得到锻炼,完成了早期的行业积累。
然而,有既得利益者必有利益损失方,相关国家及企业必然会采取相应的行动:部分专利药采取不进入印度;国际监管部门加大对印度仿制药公司的监管力度;国际大环境进行斥责;印度本国创新力无法跟进,等。所以,针对上述问题,我国每当遇到天价药时,虽“生命大于天”,但客观的现状还是要了解,并要理智的采取一些行动...至少对于一名业内人士,还是应该具备一定的辨别能力!
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#历史#
68