Nat Metab 北京大学徐明/姜长涛揭示糖尿病心肌病心脏脂代谢新机制
2024-05-07 论道心血管 论道心血管 发表于上海
该研究揭示了糖尿病心肌病心脏脂质代谢紊乱的新机制,架起了胆汁酸代谢与心脏脂代谢之间的桥梁,为改善心脏脂质代谢稳态提供了新策略。
代谢紊乱,尤其是脂质代谢紊乱,是糖尿病心肌病(DbCM)的主要特征,可导致心脏重塑和心功能障碍。维持心肌代谢平衡是DbCM的主要治疗策略。脂肪酸是心脏中ATP产生的主要底物,约占正常成人心脏能量供应的70%,在糖尿病患者中甚至更高。脂肪酸代谢包括脂肪酸的摄取、合成和消耗。在糖尿病中,胰岛素抵抗和循环FFA升高促进脂肪酸摄取并触发细胞内脂质积累。多余的脂肪酸会引发细胞脂毒性并破坏能量供应,导致糖尿病患者心功能紊乱。CD36是一种膜定位的脂肪酸转位酶,被认为是主要的脂肪酸转运蛋白,在脂质稳态中起着至关重要的作用。CD36是糖尿病患者心肌细胞脂肪酸摄取过量的主要原因,然而CD36过度活化的详细机制及其调控策略仍不完全清楚。
2024年5月2日,北京大学徐明/姜长涛在Nature Metabolism在线发表了题为“Inhibition of fatty acid uptake by TGR5 prevents diabetic cardiomyopathy”的研究论文,揭示了糖尿病心肌病心脏脂质代谢紊乱的新机制,架起了胆汁酸代谢与心脏脂代谢之间的桥梁,为改善心脏脂质代谢稳态提供了新策略。

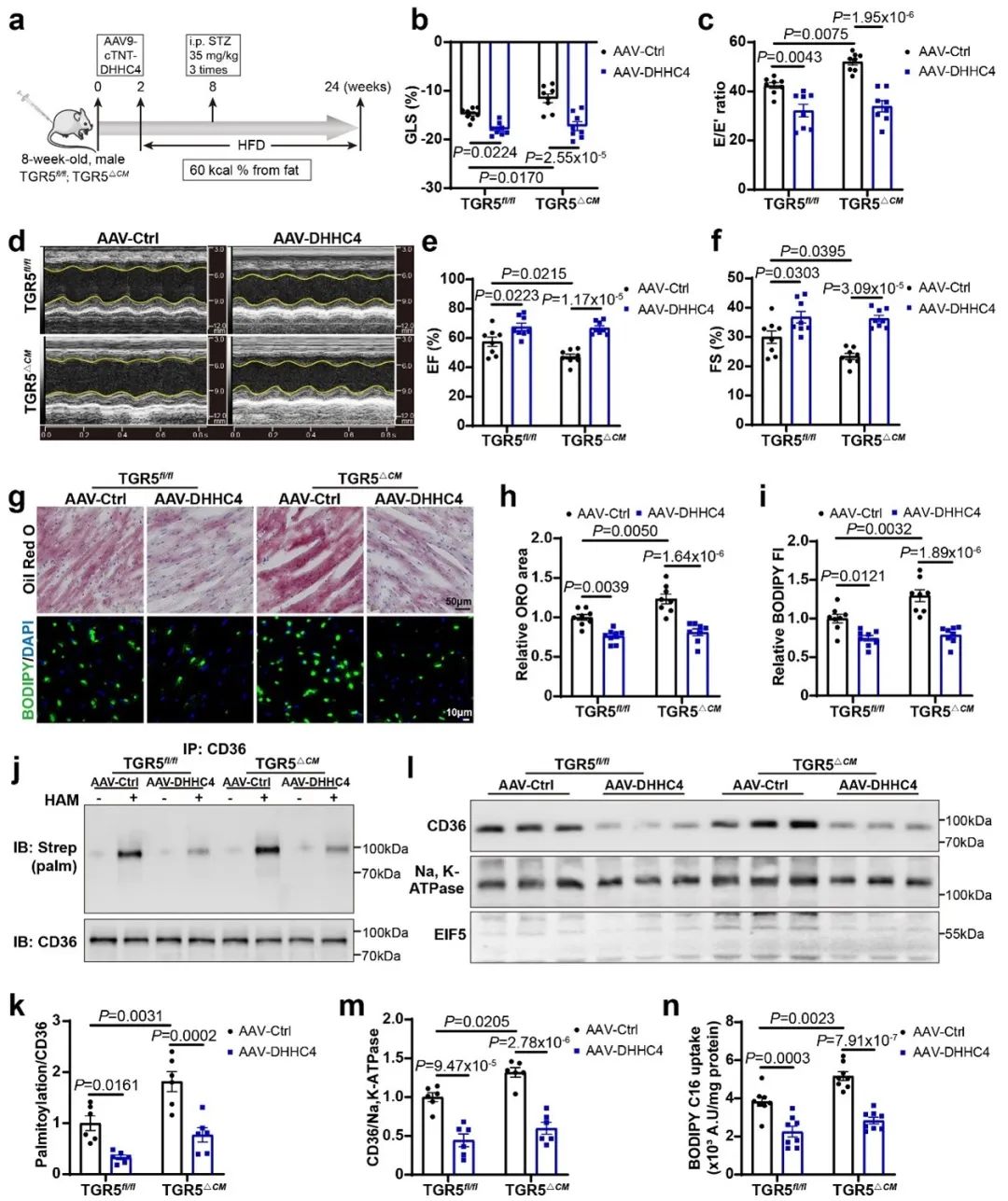
为研究DbCM胆汁酸代谢的变化,采用高脂饮食联合低剂量链脲佐菌素(HFD/STZ)构建DbCM小鼠模型。糖尿病心肌损伤小鼠血浆和心脏组织中脱氧胆酸(DCA)水平降低。为了探讨DCA受体TGR5在DbCM中的作用,团队构建了心脏特异性TGR5敲除小鼠。与TGR5fl/fl小鼠相比,TGR5△CM小鼠在糖尿病下呈现明显的心功能紊乱。
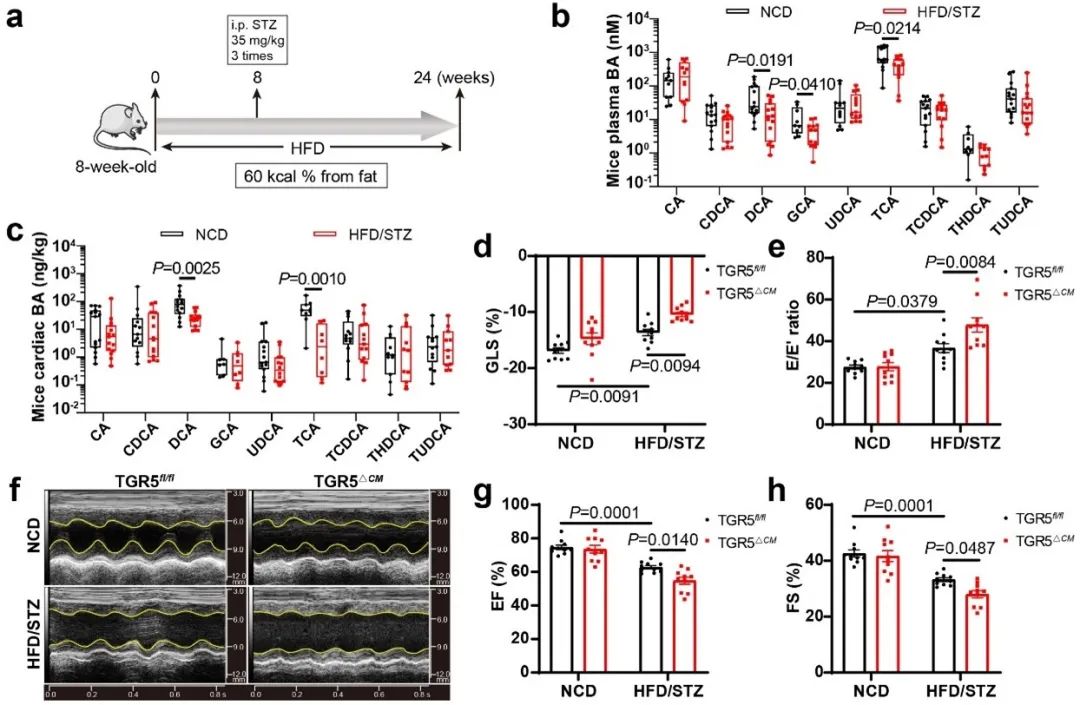
为了进一步了解心功能紊乱表型的潜在机制,该团队评估了心脏脂质代谢水平。Oil Red O染色、BODIPY 473/503染色和TG水平显示,TGR5△CM小鼠的心肌内脂质积累增加。在体外,他们也观察到棕榈酸(PA)和油酸(OA)处理的TGR5△CM原代乳小鼠心肌细胞(NMCMs)脂滴显著增加。透射电镜进一步显示,TGR5△CM小鼠的脂滴数量和大小增加。此外,与TGR5fl/fl小鼠相比,TGR5△CM小鼠心肌组织的脂质组学显示出不同的脂质组学特征。TGR5△CM小鼠的FFA、DG和TG水平显著升高。具体而言,TGR5△CM小鼠的FFA水平显著升高,尤其是长链不饱和脂肪酸显著增加。这些发现提示,TGR5缺乏促进心肌脂质积累。
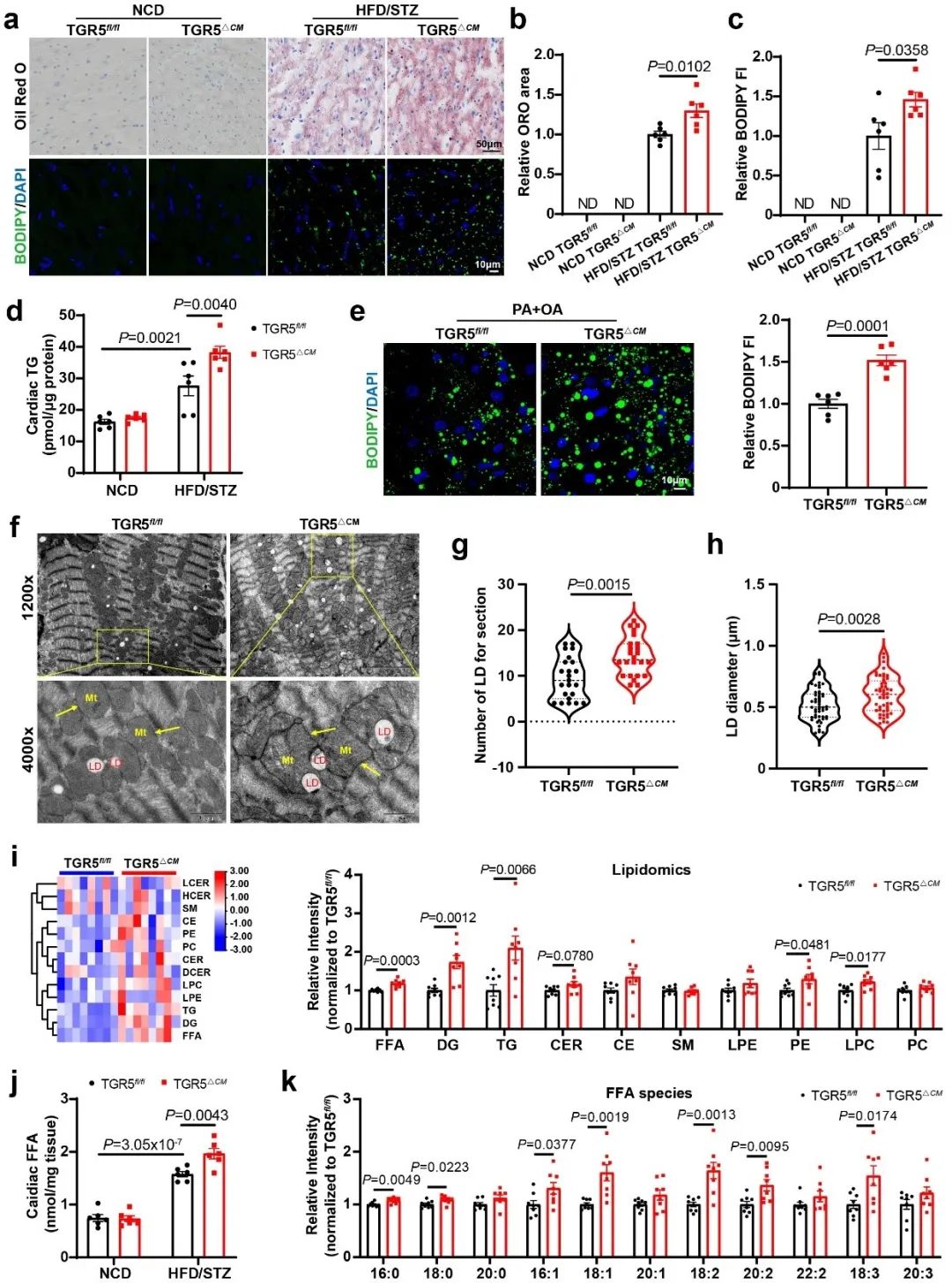
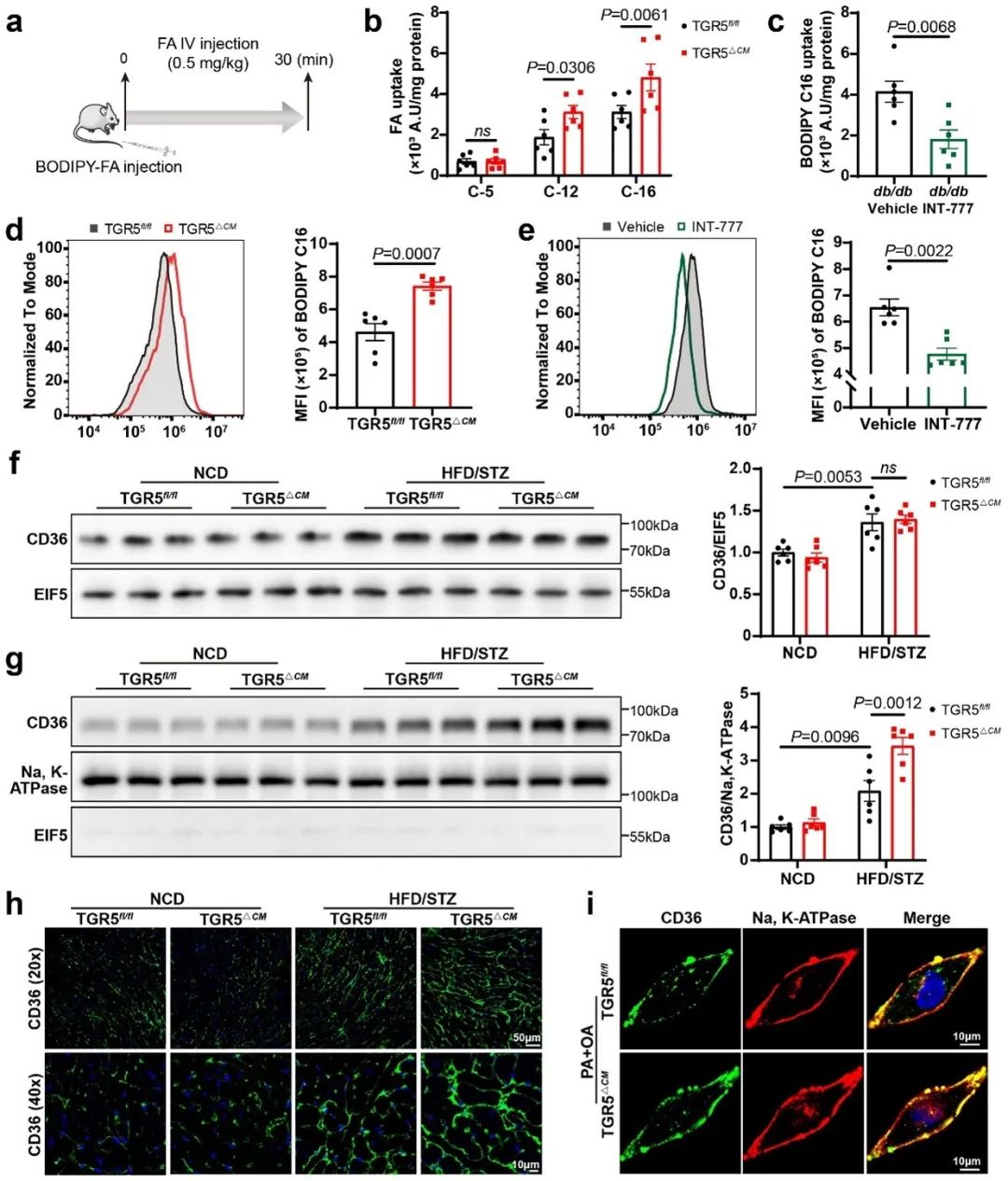
考虑到心脏脂质代谢的独特性,脂肪酸摄取和脂肪酸氧化(FAO)被评估。通过尾静脉注射BODIPY-FA评估TGR5对心肌组织脂肪酸摄取的影响,与TGR5fl/fl小鼠相比,糖尿病TGR5△CM小鼠心肌组织对长链脂肪酸的摄取增加。为了评估TGR5对FAO的影响,该团队进行了Seahorse棕榈酸盐氧化应激实验。通过在外源性棕榈酸盐存在下进行耗氧量测定,结果显示TGR5缺失的心肌细胞减少对外源性脂肪酸的利用,表明TGR5抑制脂肪酸摄取,有助于维持心肌细胞的FAO和线粒体功能。
CD36主要介导心脏长链脂肪酸的摄取,其功能依赖于其表达和在质膜上的定位。因此,他们检测了HFD/STZ诱导和db/db小鼠心脏中CD36的总蛋白和膜蛋白表达。CD36总蛋白水平在TGR5△CM小鼠和TGR5fl/fl小鼠之间无显著差异。然而,与TGR5fl/fl小鼠相比,TGR5△CM小鼠CD36的质膜定位水平升高。在TGR5△CM小鼠的原代NMCMs和经INT-777处理的NMCMs中,PA + OA诱导促进TGR5△CM细胞中CD36的质膜定位增加,而经INT-777处理的细胞中CD36的定位降低,证实了体内研究结果。
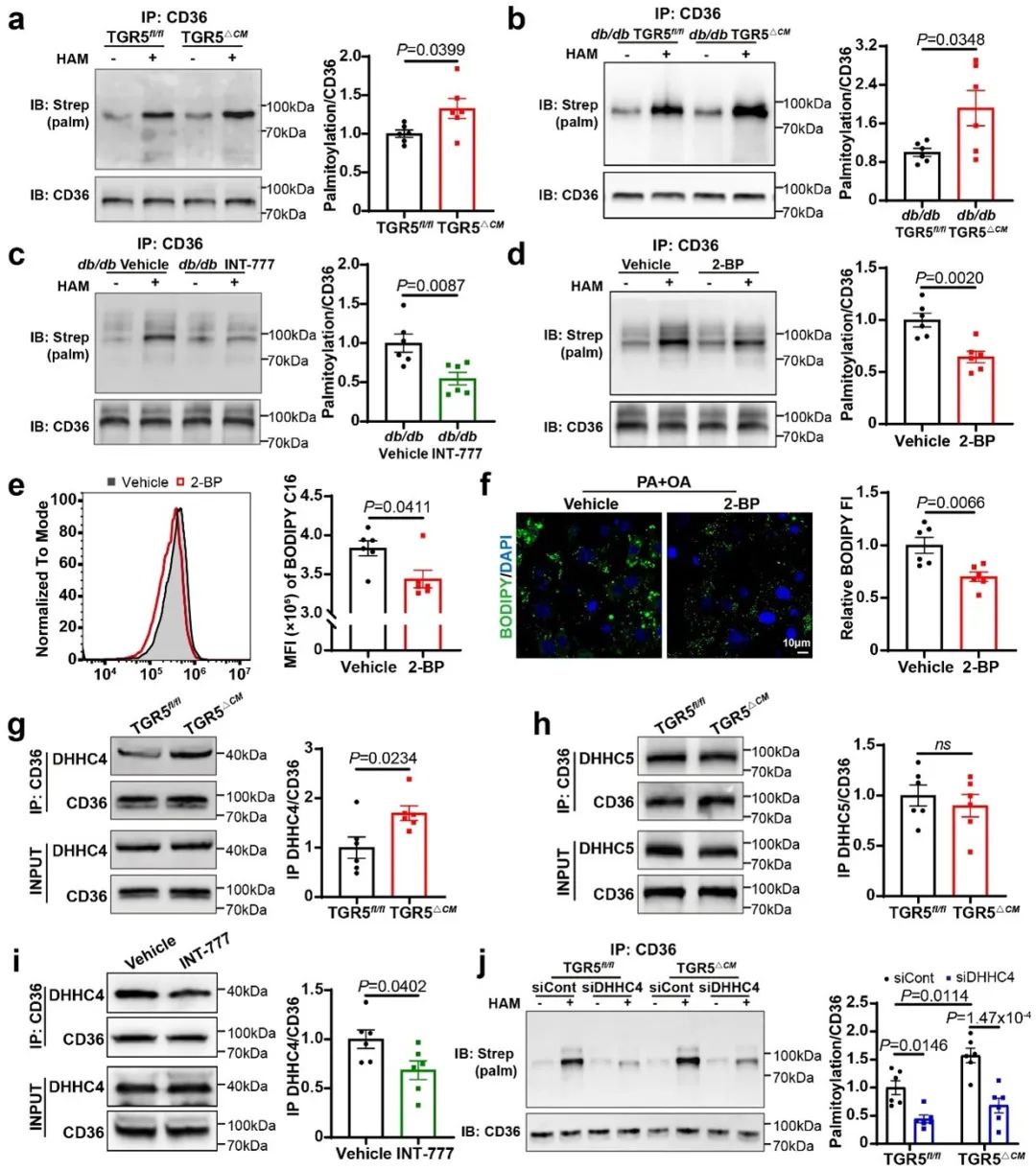
棕榈酰化是一种翻译后修饰,通过增强蛋白的亲脂性,在调节蛋白的亚细胞分布和功能中起着至关重要的作用。考虑到CD36棕榈酰化与膜蛋白质膜定位的关联,他们使用酰基生物素交换法(ABE)进行研究。糖尿病小鼠心脏中棕榈酰化CD36的水平增加,而且TGR5△CM小鼠的CD36棕榈酰化水平高于TGR5fl/fl小鼠。为了研究CD36棕榈酰化对心肌细胞脂肪酸摄取和脂质积累的影响,棕榈酰基转移酶抑制剂2-BP被用来阻断棕榈酰化,分别采用流式细胞术和BODIPY 493/503染色法评估脂肪酸摄取和脂质积累。研究结果表明,抑制棕榈酰化可显著减少心肌细胞的脂肪酸摄取和脂质蓄积。
蛋白棕榈酰化是由一组含锌指DHHC结构域的棕榈酰转移酶催化的,它们在半胱氨酸残基的巯基上添加一个棕榈酰基团。CD36棕榈酰化由DHHC4和DHHC5介导,主要负责其在质膜上的定位和随后的脂肪酸摄取。为了确定参与TGR5通路的潜在棕榈酰转移酶,他们进行了免疫共沉淀来研究CD36与DHHC4或DHHC5之间的相互作用。结果显示,TGR5的缺失增强了CD36与DHHC4的结合,但没有改变CD36与DHHC5的结合。为了进一步评估TGR5与DHHC4的相关性,他们在PA + OA刺激的NMCMs中使用小干扰RNA敲低DHHC4。结果显示,与siCont相比,siDHHC4显著降低了CD36棕榈酰化,这表明DHHC4参与了CD36棕榈酰化。此外,在缺乏TGR5的心肌细胞中,DHHC4敲低时,CD36棕榈酰化显著降低,这表明TGR5对CD36棕榈酰化的影响依赖于DHHC4。这些数据表明,TGR5/DHHC4信号介导心肌细胞中的CD36棕榈酰化。
为了进一步评估DHHC4在体内的作用,他们通过尾静脉注射AAV9-cTNT-DHHC4,在HFD/STZ诱导的TGR5fl/fl和TGR5△CM小鼠中产生心肌细胞特异性DHHC4敲低小鼠。超声心动图显示,DHHC4敲低可有效改善HFD/STZ诱导的心功能障碍,逆转TGR5缺失小鼠心功能的恶化。此外,他们观察到HFD/STZ诱导的TGR5fl/fl和TGR5△CM小鼠在DHHC4敲低作用下心肌脂质积累显著减少,表明TGR5缺失对脂质积累增加和心功能障碍的影响依赖于DHHC4的激活。
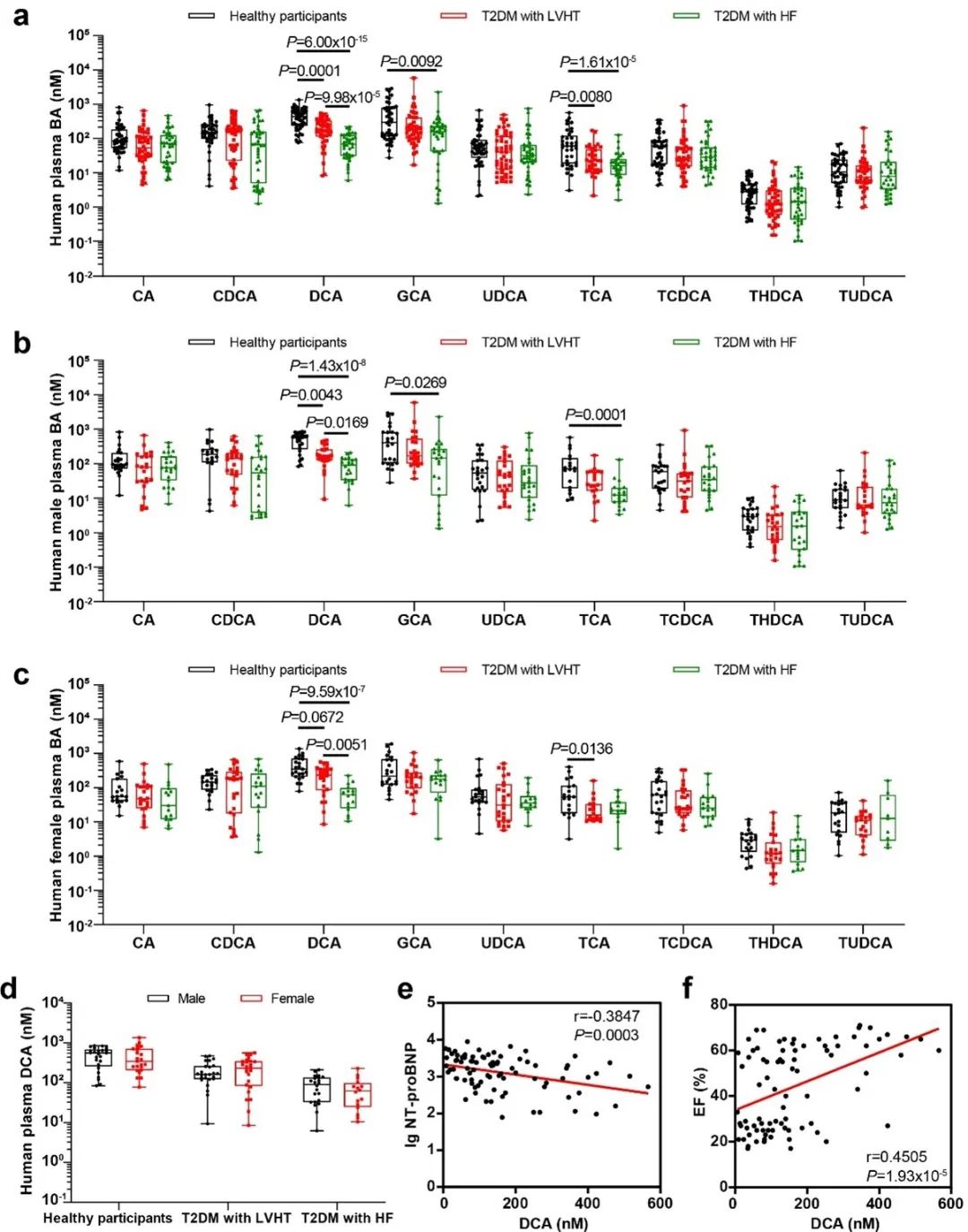
进一步地,胆汁酸靶向代谢组学对健康参与者以及伴有左室肥厚或心力衰竭的2型糖尿病患者的血浆胆汁酸进行了全面分析。分析显示特定胆汁酸发生了显著变化,特别是DCA和TCA。与健康参与者相比,糖尿病左室肥厚的患者DCA水平降低,糖尿病心衰患者的DCA水平进一步降低。在男性和女性参与者中,糖尿病左室肥厚和糖尿病心衰患者的DCA水平均显著降低,但性别间无显著差异。相关分析显示血浆DCA水平与NT-proBNP水平呈负相关,而DCA水平与EF呈正相关。总的来说,这些发现强调了胆汁酸-TGR5通路在DbCM发展中的重要作用及其作为该病诊断标志物的潜力。
北京大学第三医院徐明教授和北京大学基础医学院姜长涛教授为本文共同通讯作者。北京大学第三医院王虎博士生为本文第一作者。本研究获得科技部重点研发计划、国家自然科学基金等项目资助。
原文链接:
https://www.nature.com/articles/s42255-024-01036-5
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#糖尿病心肌病# #心脏脂代谢#
15